题目内容
【题目】粗盐中含有Mg![]() 、Ca
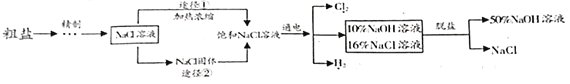
、Ca![]() 等杂质,工业提纯粗盐的工艺流程如图所示
等杂质,工业提纯粗盐的工艺流程如图所示
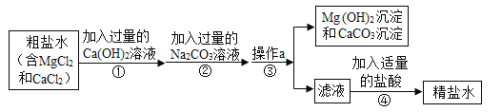
(1)Ca(OH)2溶液的pH____________(填“>”、“=”或“<”)
(2)步骤①反应的化学方程式为____________________________;
(3)步骤④加入适量盐酸的目的是除去滤液中的_____________;
(4)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有___________.
【答案】> Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓ Na2CO3和NaOH; CaCl2
【解析】
(1)Ca(OH)2溶液呈碱性,pH>7;
(2)Ca(OH)2溶液只能与粗盐水中的MgCl2反应生成氢氧化镁和氯化钙,化学反应方程式是:Ca(OH)2+MgCl2═CaCl2+Mg(OH)2↓;
(3)步骤①中过量的氢氧化钙和生成的氯化钙与步骤②中过量的碳酸钠反应碳酸钙沉淀、氯化钠、氢氧化钠,所以步骤④加入适量的盐酸可以除去滤液中步骤②加入的多余的Na2CO3和生成的NaOH;
(3)碳酸钠能与氯化镁反应生成碳酸镁和氯化钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙。若步骤①和步骤②的顺序颠倒,加入过量的碳酸钠溶液能除去氯化镁和氯化钙,再加入过量的氢氧化钙能除去过量的碳酸钠,过滤后的滤液中存在氯化钠、氢氧化钠(生成的)和氢氧化钙(过量的),再加入适量稀盐酸,氢氧化钠与盐酸反应生成氯化钠,氢氧化钙与盐酸反应生成氯化钙,最后形成的溶液中含有氯化钠、氯化钙,氯化钙的化学式是CaCl2。

【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的是( )
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
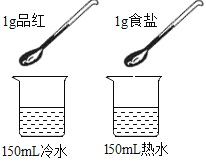
A | 探究温度对分子运动快慢的影响 |
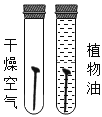
| B | 探究氧气对铁钉锈蚀的影响 |
|
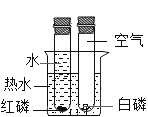
C | 探究空气是燃烧的必要条件 |
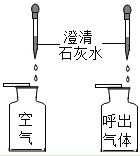
| D | 探究空气与呼出的二氧化碳含量不同 |
|
A. AB. BC. CD. D