��Ŀ����
����Ŀ����ˮɹ�οɵõ���������(NaCl�к���MgCl2��Na2SO4��CaCl2����ɳ������)��ij�ȼ�õ�⾫�Ʊ���ʳ��ˮ����ȡNaOH��H2��Cl2������������ͼ��ʾ��
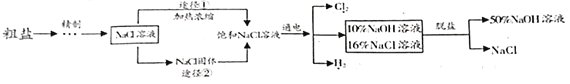
����˵������ȷ����
A. ����ʱ�ȷ����������仯Ҳ�����˻�ѧ�仯
B. ��ҵ������Ӧѡ��;�����Ʊ�NaCl������Һ
C. ���ʱ�ķ�ӦΪ2NaCl+2H2O=2NaOH+H2��+Cl2�����ù��̵���ת��Ϊ��ѧ��
D. ���ι���������NaCl��NaOH���ܽ���ϵIJ��죬ͨ�������ᾧ���ȹ��˷���õ�NaCl�����NaOH��Һ
���𰸡�C
��������
A������ʱ�ȷ����������仯Ҳ�����˻�ѧ�仯�����������⣻
B����ҵ������Ӧѡ��;�����Ʊ�NaCl������Һ�����������⣻
C����ⱥ���Ȼ�����Һ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2�����÷�Ӧ�е���ת��Ϊ��ѧ�ܣ��������⣻
2NaOH+H2��+Cl2�����÷�Ӧ�е���ת��Ϊ��ѧ�ܣ��������⣻
D�����ι���������NaCl��NaOH���ܽ���ϵIJ��죬ͨ�������ᾧ���ȹ��˷���õ�NaCl�����NaOH��Һ�����������⡣��ѡC��

����Ŀ�����л�ѧ���������ȷ���Ҽ��к�����壬�������������
ѡ�� | �� �� | ��ѧ���� |
A | 2����ԭ�� | 2Hg |
B | ����Ļ�ѧʽ | CH4 |
C | ̼��ԭ������̼ | CO2+C |
D | ������ | Cl1�� |
A. AB. BC. CD. D
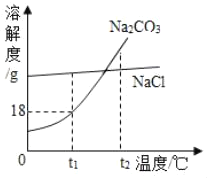
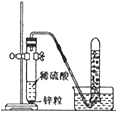
����Ŀ��ij��ȤС���ڿ����е�ȼþ��ʱ���֣����ɵİ�ɫ���������м����������ĵ���ɫ���塣Ϊ��̽����ԭ��С���Ա����������̽�����
��������⣩����ɫ�������ʵijɷ���ʲô��
����������ͨ���������ϣ���¼�����м������ʵ���ɫ��
���� | MgO | MgCl2 | Mg3N2 | Mg��NO3��2 | MgCO3 | Mg��OH��2 |
��ɫ | ��ɫ | ��ɫ | ����ɫ | ��ɫ | ��ɫ | ��ɫ |
С���Աһ����Ϊ������һ���������Ȼ�þ��������______��
��������룩����ɫ�Ĺ��������______��
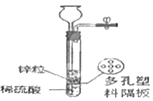
��ʵ��̽��]��1������ͼ��ʾװ���ռ�����
�ٹر�a��b��c�������۹���ȼ���ף������ײ���ȼ�ղ���ȴ�����¡�
�ڴ�a��b��ʹ�ô���Ͳ���г�����A�е�ˮ����Bʱ����c������������C���ռ���N2��ѡ����ˮ���ռ�������ԭ����______��
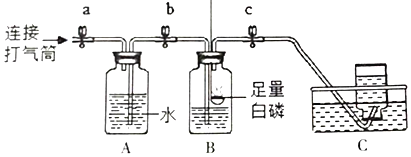
��2��ʵ����֤�ķ����ǽ�ȼ�յ�þ�����뼯��ƿ�����۲쵽______������֤������ɫ������Mg3N2��
��ʵ����ۣ���������ȷ�ģ�þ���ڿ�����ȼ�յ��йػ�ѧ��Ӧ����ʽ��______��
��ʵ�鷴˼����̽���������ȼ���µ���ʶ��______��
����Ŀ�����ࡢ��ȡ���������ѧϰ��ѧ���õķ�����
��1����ѧʵ����������Ҫ����ʵ��Ŀ�ģ���λ�Ҫ���Dz����ı����ԡ���ȫ�Ժͽ�ԼҩƷ�ȵȡ�
|
|
|
A | B | C |
����ʵ��A������______������B������C������Ϊһ�࣬������ʵ��������о�ע����ʵ��ı����Ե���ƣ�����ʵ����ʵ���������ָ���ǵ�ʵ����ƾ�����ʹ��Ӧ______��ͬ��һ��ʵ����Ƚ����ǻ���һ���ŵ���______��
��2��ͨ��ѧϰ����֪����Щ��������ˮ��Ӧ�������ɶ�Ӧ������磺CaO+H2O=Ca��OH��2��CO2+H2O=H2CO3�ȡ�ʵ���Ͽ����Եļǿ�ᶼ��������������ˮ��Ӧ�õ������մ˹��ɣ�
���������ؿ�����ˮ��______���ѧʽ����Ӧ�õ���
��д����������ˮ��Ӧ�õ�����Ļ�ѧ����ʽ______��
����Ŀ��������������ˮƽ����ߣ����Ƕ���ʳƷ����Ҫ��Ӫ������Ҫ�����г��ϳ�����һЩ�����ӷ���������ɫʳƷ������ʳƷ����һ��������װ�ı��ʼ�������Σ��ʳƷ��ȫ��ijͬѧ����һ���ڿ����з���һ��ʱ���ʳƷ���ʼ�����������̽����
���������ϣ�
��1��ʳ�︯������Ϊ������ʳ��������������ֻҪ�õ����֣��ټ��ϳ����������ˮ�����ʵ��������¾ͻ�Ѹ����������ˣ�ֻҪȱ��һ���������Ϳ��Է�ֹʳ�︯�ܣ�
��2�������ľ�����ˮ�Ե����������¼��֣�
����ʯ�� ������ ���������ƹ���
�ܹ轺����ѧʽ![]() ����ɫ����״���壬������
����ɫ����״���壬������
�����̽����
��3������̽��������Ϊ��![]() �ܵ������У����ʺ���ʳƷ���������________��������________��
�ܵ������У����ʺ���ʳƷ���������________��������________��
��4��ʵ��̽����
ʵ�� | ���� | ��Ҫ���� | ��������� |
ʵ�� | �����ֱ��ʼ��İ�װ����ȡ������Ʒ���Թ��У����й۲� | ����ƷΪ��ɫ���� | �ñ��ʼ�һ������________ |
ʵ�� | ��ʵ�� | �����ݲ�������Һ���dz��ɫ | �ñ��ʼ�________��������Ч��������Ч���� |
�����˼��
��5��ʵ��2��ַ�Ӧ���Թ���������Һ�е�һ�����е�������________��
��6�������ʳ�︯�ܵ��������������dz�����ʹ����Щ���ʼ��⣬�����Բ��õı��ʷ�����________����д��һ�ּ��ɣ�