题目内容
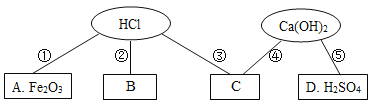
【题目】小雨收集到一瓶浑浊的河水,他要模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如图所示。请回答以下问题。
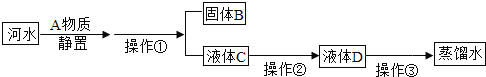
(1)A物质的名称是_____,操作①的名称是_____,若经过操作①后,所得液体C中仍有浑浊,其原因可能是_____(填写序号)。
a、漏斗内的滤纸有破损缘 b、漏斗下端未靠在烧杯内壁 c、漏斗内液面高于滤纸的边缘
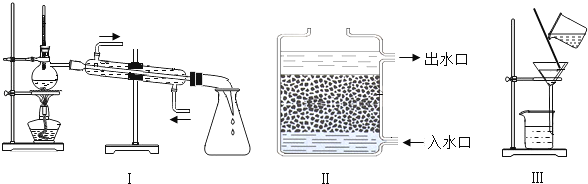
(2)操作②应选用的装置是_____(填序号),该过程主要是_____变化(填“物理”或“化学”)。
(3)小雨取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是_____水。操作③应选用的装置是_____(填序号),经过操作③以后,小雨重复上述实验,他观察到的实验现象是_____。
【答案】明矾 过滤 ac Ⅱ 物理 硬 Ⅰ 泡沫多
【解析】
硬水是指含有较多的可溶性的钙、镁化合物的水,而软水中较少含有或不含,将硬水变成软水较常用的方法是加热煮沸。
(1)在自来水厂为了将小颗粒泥尘沉降下来,常用絮凝剂,经常使用的絮凝剂是明矾,故A物质的名称是明矾,操作①是将固体和液体分离,故名称是过滤,若经过操作①后,所得液体C中仍有浑浊,其原因可能是滤纸破损或漏斗内液面高于滤纸边缘或盛接滤液的烧杯不干净等,故选ac。
(2)在过滤后的水中仍然含有可溶性的有色、有异味的物质,通常用吸附剂来吸附,吸附能力较强的是活性炭,故操作②应选用的装置是Ⅱ,该变化过程没有生成其他物质,故该过程主要是物理变化。
(3)硬水中含有较多的可溶性的钙、镁化合物,当滴加肥皂水时会出现很多的浮渣,小雨取少量液体D于试管中,加入少量肥皂水,振荡,发现有较多浮渣产生,说明液体D是硬水。操作③是蒸馏,故应选用的装置是Ⅰ,经过操作③以后,经过蒸馏后可将硬水变成软水,软水中含有的钙、镁化合物较少或没有,就会出现浮渣少,泡沫多的现象,故小雨重复上述实验,他观察到的实验现象是泡沫多。

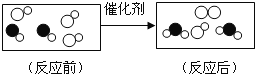
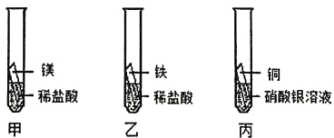
【题目】铜片在空气中久置表面会变绿。某小组同学设计并进行实验,探究铜变绿的条件。
(查阅资料)(1)、铜绿的成分是碱式碳酸铜![]() ,碱式碳酸铜能够与盐酸反应。
,碱式碳酸铜能够与盐酸反应。
(2)、浓硫酸具有吸水性,可以作为一些气体的干燥剂。
(猜想与假设)常温下,铜片变绿可能与![]() 、
、![]() 、水蒸气有关。
、水蒸气有关。
(进行实验)利用下图1装置分别制取并收集气体于试管中,制取气体原理及收集气体等操作见下表。将收集好的气体,用图2所示装置进行4个实验,通过控制与铜片接触的物质,进行实验并持续观察实验现象。
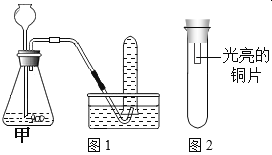
编号 | 主要实验操作 | 实验现象 |
1 | 甲中盛有过氧化氢溶液和二氧化锰,收集一试管气体 | 铜片始终无明显变化 |
2 | 甲中盛有大理石和稀盐酸,收集一试管气体 | 铜片始终无明显变化 |
3 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体 | 一段时间后铜片变绿 |
4 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体,并向气体中加入适量浓硫酸 | 铜片始终无明显变化 |
(解释与结论)
(1)实验1的目的是验证______。
(2)实验2制取气体反应的化学方程式为______。
(3)得出“铜片变绿一定与![]() 有关”的结论,依据的两个实验是______
有关”的结论,依据的两个实验是______![]() 填编号
填编号![]() 。
。
(4)实验4中,试管内的气体主要含有______。
(5)上述实验可推知,铜片变绿的条件是______。
(讨论与交流)
(6)同学们猜想碱式碳酸铜与盐酸反应有二氧化碳生成,证明此猜想所需试剂是______。
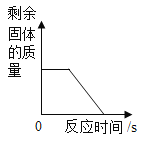
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。