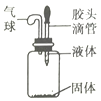
��Ŀ����
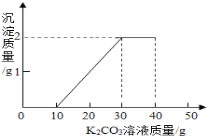
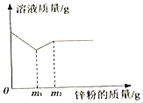
����Ŀ����ͼ��ʾ�Ǽס��ҡ����������ʵ��ܽ�����ߣ���20��ʱ���ֱ�ȡ���������������ʵı�����Һ������ֻ�ձ��У�Ȼ������Һ�ֱ�������������Ӧ�������ʣ��ٽ��¶����ߵ�40�棬���������ȫ���ܽ⣬�����ʲ����ܽ⣬�Իش��������⣺

��1�������ʵ��ܽ������_____��
��2������д���ס��ҡ����������ʵ��ܽ�����ߵ���ţ�_____��
��3��40��ʱ���������ס��ҡ����������ʵı�����Һ�к�ˮ���ٵ���_____���ʣ�
��4��40��ʱ������Һ��������������_____���ڱ���Һ��������������������һ����������һ��������
��5����40��ʱ�������ʵı�����Һ�����µ�30�棬������Һ���������������ɴ�С��˳����_____���üס��ҡ�����գ���
��6����40��ʱa���ߴ��������ʵ��ܽ��Ϊ50g���ֽ�40��ʱ75g�����ʵı�����Һ��ˮϡ�͵�10%����Ҫ_____����ˮ������ȡˮʱ���Ӷ����������Ƶ���Һ��������������_____����ƫ��ƫС���߲��䣩��
���𰸡���ȫ���ܽ⣬�ҹ������� acb �� ��һ�� ��=������ 175 ƫС
��������
��1�����ܽ�����߿��Կ������¶���20�����ߵ�40�棬a��b���ܽ������c���ܽ�ȼ�С����20��ʱ���������������ʵı�����Һ�У��������������Ӧ�������ʣ��ٽ��¶����ߵ�40�棬���������ȫ���ܽ⣬�����ʲ����ܽ⣬˵���ס��������ʵ��ܽ�������¶ȵ����߶������Ҽ��ܽ�����¶ȵ�Ӱ���������������Ӧ���ܽ�������¶ȵ����߶���С���������ʵ��ܽ��������ȫ���ܽ�������ࣻ�����ȫ���ܽ�,�ҹ�������
��2���ɣ�1���ķ�����֪���ס��ҡ����������ʵ��ܽ�����ߵ����Ϊacb�����acb
��3��40��ʱ�����ܽ����ʵ�����������Һ�к�ˮ���ٵ��Ǽף������
��4����Ϊ��ȷ���ס�����Һ�Ƿͣ��������Ƚϼס�������Һ�����ʵ����������������һ��
��5�����ܽ�����߿�֪����40��ʱ�������ʵı�����Һ�����µ�30�棬�ס������ʵ��ܽ�������¶ȵĽ��Ͷ����٣�����30��ʱ���ס������ܽ����ȣ�����������ȣ������������¶ȵĽ��Ͷ����ߣ���Ϊû�и�����������ܽ⣬��������������䣻���������Һ���������������ɴ�С��˳���Ǽ�=��>���������=��>��
��6����40��ʱa���ߴ��������ʵ��ܽ��Ϊ50g����˿�֪a�����������ʵ���������Ϊ![]() ��������Һ��ϡ��ԭ����ϡ��ǰ�����ʵ��������䣬����ϡ�ͺ���Һ������Ϊx��
��������Һ��ϡ��ԭ����ϡ��ǰ�����ʵ��������䣬����ϡ�ͺ���Һ������Ϊx��![]() �����x=250g����ˮ������Ϊ��250g-75g=175g����ȡˮʱ���Ӷ�����ʹ����ȡ��ˮƫ�࣬ʹ����Һ���������������Ƶ���Һ�ܵ���������ƫС�����175g��ƫС
�����x=250g����ˮ������Ϊ��250g-75g=175g����ȡˮʱ���Ӷ�����ʹ����ȡ��ˮƫ�࣬ʹ����Һ���������������Ƶ���Һ�ܵ���������ƫС�����175g��ƫС

����Ŀ��ij�����õ�ⱥ��ʳ��ˮ�ķ��������������ռ�����Ȼ�����Ʒ����Ӧ�Ļ�ѧ����ʽ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2���������ֹ�ҵ��Ϊ���ȼҵ����ij�о���ѧϰС��Ըó��������ռ���Ʒ��������̽����
2NaOH+H2��+Cl2���������ֹ�ҵ��Ϊ���ȼҵ����ij�о���ѧϰС��Ըó��������ռ���Ʒ��������̽����
��������⣩�ռ���Ʒ�к�����Щ���ʣ�
�����룩����һ�����ܺ���Na2CO3�������˲���������ǣ�________���û�ѧ����ʽ��ʾ����
����������ܺ���NaCl
�����ʵ�飩
ʵ�鲽�� | ʵ������ | ���ͻ���� |
��ȡ�����ռ���Ʒ�����Թ��У���ˮ�ܽ⣬�����ִ����Թ���� | �Թ���ڷ��� | ԭ����______ |
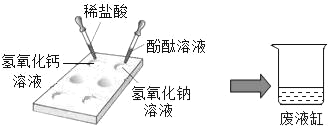
��������õ���Һ������ϡ���������� | һ��ʼ����������һ��ʱ��������ʹ����ʯ��ˮ���ǵ����� | ��Ʒ�к��е�������________ |
��������õ���Һ�еμӼ��� _____��Һ | ������ɫ���� | ��Ʒ�л����в�����е�����___________�� |
�����������ۣ�С��ͬѧ�����������ʵ����ϡ����Ҳ������ϡ���������������Ϊ���Ĺ۵�_____��������ȷ����������ȷ������