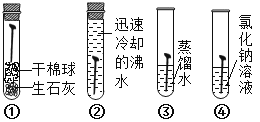
��Ŀ����
����Ŀ������θҺ�к��е�����_______________����ͼ��մ�����յ�ij����IJ���˵����ͬѧ�ǶԴ�չ����ϵ���о���

���÷���̽����Ϊʲô�������ã�����Ϊ�����õ��Ե���____________��
��.����ԭ��̽����
��1������NaHCO3��Al(OH)3��ҩƬ������������θ����࣬��Ӧԭ���÷���ʽ�ɱ�ʾΪ����дһ����_______________��
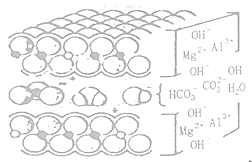
��2���������Ͽ�֪��̼��þ�Dz�״�ṹ����ͼ��������̼��þ���������õ����ķ�����____��
��.���ɷ�̽����
���������ϣ���̼��þƬ�Ӹзֽ�IJ���ΪAl2O3��MgO��CO2��H2O��ҩƷ�е������ɷ��ܲ��ֽ⡣
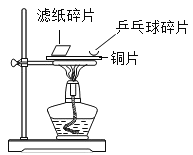
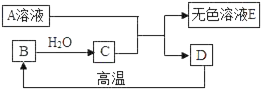
��ʵ����̣�ѧϰС���������ͼ��ʵ��̽����̼��þƬ����ɡ�

��1�����װ�������ԣ�ȡ8.6g��ҩƬ���гɷ�ĩ����Ӳ�ʲ������У�
��2��ʵ�鿪ʼǰ��ͨ��һ����������Ȼ�����װ��D��������
��3����ȼ�����Ƽ��ȡ���ַ�Ӧ��ͣ�ü��ȣ�
��4��ͨ���������������ȴ��Ŀ���Ƿ�ֹҺ�嵹����___________��Ȼ����װ��D����0.44g��
��ʵ����ۣ���̼��þ�Ļ�ѧʽΪ____________��ҩƬ����̼��þ������������________��
����չ���죩��ҽ�������黼������θ�͡�θ����Ļ���������ø�ҩ���ķ���������Ƭ��������ѧ��֪ʶ�������������������_____________��
���𰸡����� ����ҩ����θҺ�ĽӴ������ʹҩ����θҺ��ַ�Ӧ NaHCO3+HCl=NaCl+H2O+CO2����Al(OH)3+3HCl=AlCl3+3H2O OH-��CO32- �ų�����ֽ������H2O��CO2��ʹ���DZ�װ��C��D������� Al2Mg6(OH)16CO34H2O 70% ��������θ�͡�θ����Ļ���θ�ڽϱ���θ����Ҫ�ɷ������ᣬ����̼��þ��Ӧ���ɵĶ�����̼��̼�ΪճĤ������θ����
��������
����θҺ�к��е��������ᡣ
��.��Ӧ��֮��Ӵ����Խ��ӦԽ��֡���������õ�Ŀ��������ҩ����θҺ�ĽӴ������ʹҩ����θҺ��ַ�Ӧ��
��. (1)NaHCO3�����ᷴӦ�����Ȼ��ơ�ˮ��������̼��NaHCO3+HCl=NaCl+H2O+CO2����Al(OH)3�����ᷴӦ�����Ȼ�����ˮ��Al(OH)3+3HCl=AlCl3+3H2O��(2)�����ԭ�������к������е�H+����̼��þ�е�OH-��CO32-�����к�θ���е�H+��
��. (4)����ͨ���������������ȴ��Ŀ���Ƿ�ֹҺ�嵹�����ų�����ֽ������H2O��CO2��ʹ���DZ�װ��C��D������ա�
[ʵ�����]���ݸÿ���ҩ�IJ���˵��������̼��þ�Ļ�ѧʽΪAl2Mg6(OH)nCO34H2O�����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ�㣬��+3����2+��+2����6+��-1����n+��-2��=0�����n=16��������̼��þ�Ļ�ѧʽΪAl2Mg6(OH)16CO34H2O����ҩƬ����̼��þ������Ϊx��

![]() �����x=6.02g
�����x=6.02g
��ҩƬ����̼��þ����������Ϊ��![]() ��100%=70%
��100%=70%
[��չ����]��ҽ�����黼������θ�͡�θ����Ļ���������ø�ҩ���ķ���������Ƭ��ԭ���ǻ�������θ�͡�θ����Ļ��ߵ�θ�ڽϱ���θ����Ҫ�ɷ������ᣬ����̼��þ��Ӧ���ɵĶ�����̼��̼�θճĤ������θ���ס�

����Ŀ���±��� NaHCO3��NH4Cl�ڲ�ͬ�¶��µ��ܽ�ȡ�����˵������ȷ���ǣ�������
�¶�/�� | 20 | 30 | 40 | 50 | |
�ܽ��/g | NaHCO3 | 10.0 | 11.0 | 13.0 | 14.0 |
NH4Cl | 35.0 | 39.0 | 43.0 | 48.0 | |
A.20��ʱ�����Ƶ������� NaHCO3��NH4Cl������Һ��NH4Cl��Ҫˮ��
B.���Ͱ���ˮ����CO2�����ɵ� NaHCO3��NH4Cl��NaHCO3�Ƚᾧ����
C.20��ʱ��NaHCO3������Һ��������������Ϊ10%
D.50��ʱ��148g NH4Cl������Һ���µ�20�棬����13 g NH4Cl����