题目内容
为测定实验室一瓶放置已久的烧碱中NaOH含量,取50g的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395. 6g。计算:
(1)反应产生的CO2的质量为________g。
(2)样品中NaOH的质量分数是多少?
(1)反应产生的CO2的质量为________g。
(2)样品中NaOH的质量分数是多少?
(1)4.4g(2分)(2)78.8%(3分)
试题分析:根据题意可知,由于该反应有气体放出,故溶液减少的质量就是生成的CO2的质量;然后根据CO2的质量,结合反应中CO2与Na2CO3的质量比,就可以求出烧碱变质后生成的碳酸钠的质量,再用烧碱样品的质量减去碳酸钠的质量就是样品中NaOH的质量,最后根据公式,NaOH质量分数=
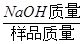 ×100%,即可求解。
×100%,即可求解。解:根据题意可知,反应后生成CO2的质量为=200g+200g-395.6g=4.4g;
设样品中Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
106:44=x:4.4g
解得,x=10.6g
则样品中NaOH的质量=50g-10.6g=39.4g
所以,样品中NaOH的质量分数=
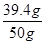 ×100%=78.8%
×100%=78.8%答:(1)反应生成CO2的质量为4.4g,(2)样品中NaOH的质量分数为78.8%。
点评:此题是关于化学方程式的计算题,主要是利用反应方程式来分析和解决化学计算中的有关问题,要求学生要有较强的分析能力,解题的关键是要明确,在该类型的化学计算题中溶液减少的质量就是生成气体的质量,将气体的质量带入化学方程式计算,然后根据题目的数量关系就可以得出正确答案。

练习册系列答案
相关题目

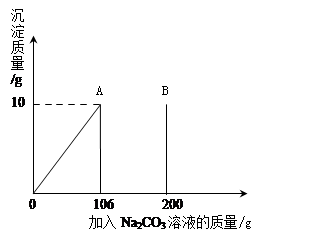
 Na2CO3+H2O
Na2CO3+H2O