题目内容
【题目】实验探究和证据推理是提升认知的重要手段,化学兴趣小组对"CO2与NaOH溶液反应”的实验进行探究。
Ⅰ探究CO2的制备
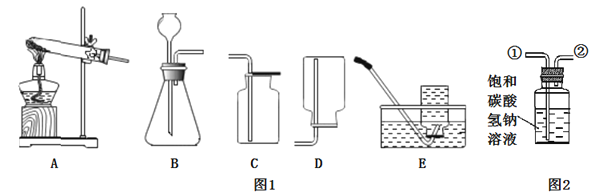
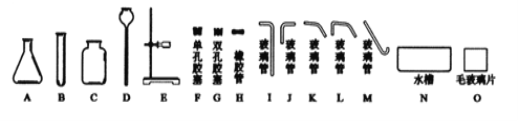
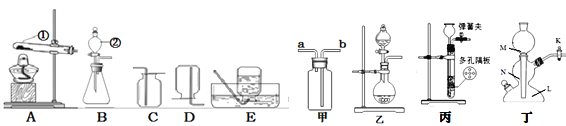
(1)实验室通常利用上图1中__(填字母)装置的组合制取并收集二氧化碳,反应的化学方程式为________
(2)图2所示装置可用于除去二氧化碳中少量的氯化氢气体,除杂时应将混合气体从导管____(填“①”或“②”)通入装置中。
Ⅱ探究CO2与NaOH溶液能否反应
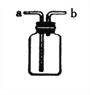
实验甲:向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡后放在水平的桌面上(如图3)。
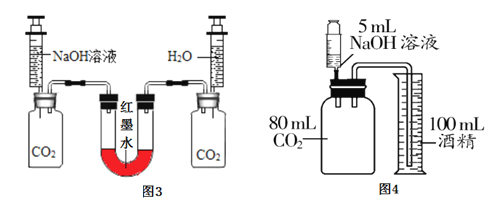
(1)若观察到U型左端液面_______(填“升高”成“降低”),则证明氢氧化钠能与二氧化碳反应。
(2)对静置后左瓶内的溶液进行下列操作,由对应的现象可推知CO2与NaOH一定反应的是_____(填对应选项的字母)。
a.滴加酚酞,溶液变为红色 b.滴加少量稀盐酸,不产生气泡 C,滴加少量氯化钙溶液,产生白色沉淀
实验乙:在NaOH固体中加入适量95%的乙醇溶液,配制成饱和NaOH的乙醇溶液,向该溶液中通入CO2,直至产生白色沉淀Na2CO3,证明氢氧化钠能与二氧化碳反应。
(3)该实验利用的原理是:___________影响物质的溶解性。
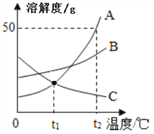
实验丙:如图4所示,将5mL溶质质量分数为10%的NaOH溶液(ρ≈1.1gmL)缓慢、全部注射入瓶中,观察到酒精倒流入瓶中,最终瓶中剩余5mL气体。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精。
(4)实验时_____________(填“能”或“不能”)用水代替量筒中的酒精。
(5)实验时将NaOH溶液缓慢注射入瓶中的原因是____________________。
(6)根据上述实验可推知:与NaOH反应的CO2约为________________(取整数)mL
【答案】 BC CaCO3 +2HCl==CaCl2 + H2O +CO2↑ ① 升高 C 溶剂 不能 防止CO2气体从导管逸出 70
【解析】本题主要考查了二氧化碳的制取,碱、盐的化学性质,物质的溶解性的影响因素等,综合性较强,仔细审题,弄清题意,灵活运用所学的知识。
Ⅰ探究CO2的制备
(1)实验室制取CO2,在常温下,用大理石或石灰石和稀盐酸制取,属于固—液常温型;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,所以利用上图1中BC装置的组合制取并收集二氧化碳;碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,,反应的化学方程式为CaCO3 +2HCl==CaCl2 + H2O +CO2↑;
(2)图2所示装置可用于除去二氧化碳中少量的氯化氢气体,除杂时为了使混合气体与碳酸氢钠溶液充分接触,应将混合气体从导管①通入装置中;
Ⅱ探究CO2与NaOH溶液能否反应
(1)根据CO2与NaOH的反应,是气体被氢氧化钠溶液吸收,二氧化碳气体减少了,则U型管的左端的气压减小,从而导致U型管的左端液面升高;
(2)a、要证明CO2与NaOH溶液一定发生反应,只要证明反应后的溶液中含有Na2CO3即可。Na2CO3和NaOH溶液都呈碱性,因此无论CO2与氢氧化钠溶液是否反应,都会是无色酚酞试液变红,错误;b、如果NaOH溶液过量,滴加少量的稀盐酸会先与NaOH溶液反应,不会产生气泡,应滴加过量的稀盐酸,观察是否有气泡产生才能得到正确的结论,错误;c、氯化钙溶液不能与氢氧化钠溶液反应,氯化钙溶液能与碳酸钠溶液反应产生白色沉淀,如果有白色沉淀生成,说明一定含有碳酸钠,也就证明CO2与NaOH溶液一定发生了反应,正确。故选C;
(3) 将CO2通入氢氧化钠溶液生成的碳酸钠易溶于水,无明显变化,CO2通入氢氧化钠乙醇溶液生成的碳酸钠不能溶于乙醇,形成沉淀。实验乙利用的原理是溶剂影响物质的溶解性。
(4)二氧化碳能溶于水而不能溶液乙醇,实验时不能用水代替量筒中的酒精;
(5) 为了使二氧化碳能与氢氧化钠溶液充分反应,防止二氧化碳气体从导管逸出,实验时应将氢氧化钠溶液缓缓注入注射器中。实验时将NaOH溶液缓慢注射入瓶中的原因是防止CO2气体从导管逸出;
(6)加入氢氧化钠的溶液是5mL,1体积水约可溶1体积CO2,最终瓶中剩余5mL气体。可推知与NaOH反应的CO2≈80mL-5mL-5mL=70mL。

【题目】通过对常见的酸和碱性质的学习,我们知道了酸能与某些金属单质发生反应,但并未提及碱溶液与单质的反应,实际上碱溶液也能与某些非金属单质反应,如氢氧化钠溶液能与氯气发生如下反应:
①![]()
②![]()
某化学兴趣小组的同学在实验室的实验台上发现上一组的同学做完氯气与氢氧化钠溶液的反应后残液未倒掉,遂对该残液的成分进行猜想和实验验证。请你与他们一起完成探究过程。
【猜想】除水外(1)可能含 NaClO和NaCl
(2)可能含 NaClO、NaCl和NaOH
(3)可能含NaClO3、NaCl
你认为还可能是______________________.
【查阅资料】
(1)次氯酸钠(NaClO)溶液呈碱性;有强氧化性,可使淀粉碘化钾试纸变蓝;不稳定,在光照或加热条件下均能分解:2NaClO![]() 2NaCl+O2↑;3 NaClO
2NaCl+O2↑;3 NaClO![]() NaClO3+2NaCl
NaClO3+2NaCl
(2)氯酸钠溶液呈中性。
【实验验证】
实验步骤 | 现象 | 结论 |
(1)取残液滴在淀粉碘化钾试纸上 | 试纸变蓝 | _______________ |
(2)取残液于试管中,加热一段时间,冷却后___________ | 试纸不再变蓝 | ________________ |
(3)________________ | _____________ | 猜想2正确 |
【反思交流】对反应后溶液中溶质的确定,除考虑生成物外还应考虑_____________
【题目】某校化学兴趣小组想检测黄铜(铜、锌合金)中铜的质量分数,组员们取10g黄铜样品,向其中分三次共加入30g稀硫酸溶液,充分反应后测得实验结果如下:
实验次数 | 1 | 2 | 3 |
硫酸质量 | 10g | 10g | 10g |
氢气质量 | 0.04g | m | 0.02g |
试计算:
(1)第二次实验产生氢气的质量m为___________g。
(2)黄铜(铜、锌合金)中金属铜的质量分数__________。