题目内容
【题目】如下图是甲、乙两种物质的溶解度曲线。下列说法错误的是( )
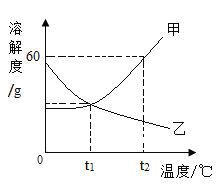
A.t1℃时,甲乙两种物质的饱和溶液中溶质的质量一定相等
B.t2℃时,甲物质的溶解度大于乙物质的溶解度
C.甲物质中含有少量乙物质,可以用冷却热饱和溶液的方法提纯甲
D.t2℃时,将40g甲固体加入50水,充分搅拌后能得到80g溶液
【答案】A
【解析】
A、t1℃时,甲和乙的溶解度相等,甲、乙两种物质的饱和溶液中溶质质量分数相等,但是没说明溶液质量,不能判断含溶质是否相等,故A错误;
B、从t2℃向上作垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小是甲>乙,故B正确;
C、如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂。由于甲的溶解度受温度影响较大,所以用冷却热饱和溶液的方法提纯甲,故C说法正确;
D、t2℃甲物质的溶解度是60g,即在t2℃100g水中最多溶解60g甲物质,所以50g水中最多溶解30g甲物质,所得溶液质量为:50g+30g=80g,故D正确。故选A。

练习册系列答案
相关题目