题目内容
【题目】某化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取10g石灰石样品,把40g稀盐酸分4次加入样品中(样品中的其它成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥、称量等操作,实验数据如下表:
实验 | 第一次 | 第二次 | 第三次 | 第四次 |
稀盐酸的用量 | 10g | 10 g | 10 g | 10 g |
剩余固体的质量 | X g | 4 g | 2 g | 2 g |
(1)表中X的值 为________g;
(2)该石灰石样品中碳酸钙的质量分数为_______;
(3)计算实验过程中产生二氧化碳气体的质量_______。(写出计算过程)
【答案】7 80% 3.52g
【解析】
(1)第二次结束固体减少了6g,可知第一次应该减少3g,所以x=7,同时可知每10g盐酸与3g碳酸钙恰好完全反应,最后剩余2g为杂质,即碳酸钙的质量为10g﹣2g=8g,该石灰石样品中碳酸钙的质量分数=![]() ;
;
设:产生二氧化碳的质量为x
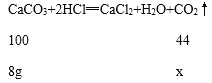
![]() x=3.52g。
x=3.52g。
答:(1)表中x的值为7 g;
(2)该石灰石样品中碳酸钙的质量分数为 80%;
(3)实验过程中产生二氧化碳气体的质量为3.52g。

练习册系列答案
相关题目