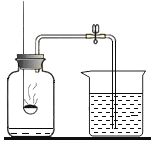
题目内容
【题目】如图A为碳还原氧化铜的实验装置图。老师指出反应物不同的质量比可能会影响生成物的种类,在学习时,可以从定性观察和定量分析两个角度来判断生成物。请你跟随老师的思路,探究碳还原氧化铜生成的气体.(浓硫酸具有吸水性)
(提出问题):碳还原氧化铜生成的气体是什么?
(作出猜想):猜想①:CO 猜想②:CO2 猜想③:_____
(实验设计):装置图如图:
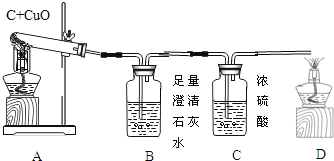
方案一:从定性观察角度判断:
若猜想3成立B处的现象是_____,D处发生反应的化学反应方程式_____
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
Ⅰ、若猜想②成立,则m4m3_____m1m2(选填“>”、“<”或“=”),此时A中的现象是_____;B发生反应的化学方程式为_____
Ⅱ、实际测量中B增加的质量小于理论值,请你分析可能的原因_____
【答案】CO和CO2 澄清石灰水变浑浊 2CO+O2![]() 2CO2 = 黑色粉末变红色 CO2+Ca(OH)2=CaCO3↓+H2O 装置内会残留少量的CO2未被澄清石灰水吸收
2CO2 = 黑色粉末变红色 CO2+Ca(OH)2=CaCO3↓+H2O 装置内会残留少量的CO2未被澄清石灰水吸收
【解析】
(1)作出猜想:
根据质量守恒定律进行猜想。猜想①:CO;猜想②:CO2;猜想③:CO和CO2;
(2)实验设计:
方案一:若猜想3成立,碳还原氧化铜生成的气体是CO和CO2,二氧化碳能使澄清石灰水变浑浊,B处的现象是:澄清石灰水变浑浊;D处发生反应是一氧化碳和氧气在点燃的条件下生成二氧化碳,反应的化学方程式为:2CO+O2![]() 2CO2;
2CO2;
方案二:
Ⅰm4-m3是反应生成的二氧化碳质量,m1-m2是参加反应的碳元素和氧元素的质量和,若猜想②成立,则反应生成的二氧化碳被B中的澄清石灰水吸收,生成的二氧化碳来自固体减少的质量,m4-m3= m1-m2,此时A中的现象是:黑色粉末变红色;B中二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
Ⅱ实际测量中B增加的质量小于理论值,因为装置内会残留少量的CO2未被澄清石灰水吸收。

 名校课堂系列答案
名校课堂系列答案【题目】(1)小明在帮老师整理实验室时,发现一瓶未密封的NaOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究
(查阅资料):①NaOH暴露在空气中易变质请用化学方程式解释NaOH变质的原因_____
②Na2CO3溶液呈碱性,BaCl2溶液NaCl溶液呈中性
(猜想假设):假设I:只含NaOH;假设Ⅱ:含NaOH和Na2CO3;假设Ⅲ:只含Na2CO3
(进行实验):
实验操作步骤 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
②另取少量样品于试管中,加水溶解,加入 过量的BaCl2溶液,振荡,静置 | _____ | 假设Ⅲ正确 |
③取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论):步骤②中加入过量BaCl2溶液的作用是_____,如将②中BaCl2溶液换成Ba(OH)2溶液,实验能否成功?_____(填“能”或“不能”),原因是_____
(2)小红为了测定一瓶未密封保存已部分变质的NaOH固体中NaOH的质量分数,采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;
②在样品溶液中加入足量的BaCl2溶液;
③待反应完全后,过滤有关数据记录如下表:
反应前 | 反应后 | |
烧杯和样品溶液总质量/g | 加入氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
①在反应前后的溶液中,下列元素质量保持不变的是_____
A钠元素 B碳元素 C钡元素 D氧元素
②原样品中NaOH的质量分数是多少?(写出计算过程)_____
【题目】宏观和微观相结合是认识物质结构的有效方法之一。
已知:X、Y、Z、W四种粒子的核电荷数及核外各电子层电子排布情况如下表。
X | Y | Z | W | U | ||
对应元素名称 | 氧 | 镁 | 铝 | 氯 | 氩 | |
核电荷数 | 8 | 12 | 13 | 17 | 18 | |
电子层 | 第一层 | 2 | 2 | 2 | 2 | 2 |
第二层 | 6 | 8 | 8 | 8 | 8 | |
第三层 | a | 8 | 8 | |||
请回答下列问题
(1)若Z表示原子,a=_______。 单质X2与单质Z的反应中,Z原子______(填“得到”或“失去”电子。
(2)具有相对稳定结构的原子是_______(填粒子符号)
(3)Y、W形成的化合物溶解于水形成的水溶液易导电,因为该化合物溶解于水会解离出_____________(用离子符号表示)。
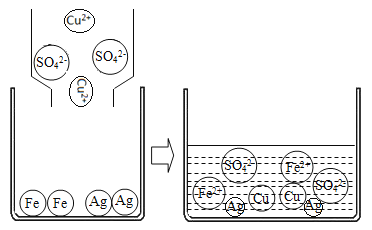
(4)将硫酸铜溶液与烧杯中Fe、Ag两种金属相混合,微观变化情况如图:则变化过程中的微观反应实质是___________,并写出本质相同的另一个化学反应方程式_____________(反应物之一必须为铁)。
【题目】回答下列与氧气有关的化学实验的问题:
A | B | C |
|
|
|
(1)实验A电解水生成氧气的化学方程式为______。
(2)用实验B测定空气中氧气的含量,当集气瓶冷却到室温打开弹簧夹后的现象是_____。
(3)用实验C探究燃烧的条件。通过______得出燃烧条件之一是与氧气接触;通过观察铜片上的现象,可以得出的结论是_________________。