题目内容
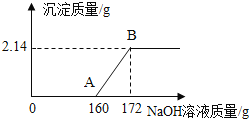
【题目】向100g氯化镁溶液中,不断加入一定溶质质量分数的氢氧化钾溶液,实验数据如下表:
氢氧化钾溶液的质量/g | 5.6 | 11.2 | 22.4 | 33.6 |
生成沉淀的质量/g | 0.145 | 0.29 | 0.58 | 0.58 |
(1)当滴加氢氧化钾溶液的质量为33.6g时,所得溶液的pH_____(填“<”“=”或“>”)7。
(2)选择合理的数据,计算该氯化镁溶液中溶质的质量分数_____。
(3)计算所用的氢氧化钾溶液中溶质的质量分数_____。
【答案】> 0.95% 5%
【解析】
(1)根据前三组数据可知,22.4g氢氧化钾溶液和100g氯化镁溶液恰好完全反应生成0.58g氢氧化镁沉淀。所以滴加氢氧化钾溶液的质量为33.6g时,氢氧化钾剩余,所得溶液的pH>7。
(2)设:该氯化镁溶液中溶质的质量分数为x。所用的氢氧化钾溶液中溶质的质量分数为y。
MgCl2+2KOH=2KCl+Mg(OH)2↓
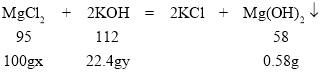
![]() =
=![]()
x=0.95%
氯化镁溶液中溶质的质量分数0.95%;
(3)![]() =
=![]()
y=5%
氢氧化钾溶液中溶质的质量分数5%。

 口算能手系列答案
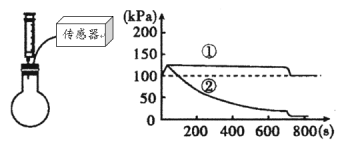
口算能手系列答案【题目】某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 1.00 | 6.00 |
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)