题目内容
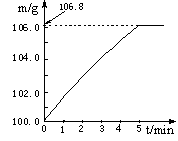
某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5 g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收。测得吸收氨气的溶液总质量m与反应时间t的变化如下图所示。所涉及的反应为:
(NH4)2SO4+2NaOH Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
请计算:
(1)完全反应后产生氨气 g。
(2)该化肥的含氮量为 (精确到0.1%),则这种化肥属于 (填:“合格”或“不合格”。合格硫酸铵含氮量为20%以上)产品。
(3)请计算废硫酸中硫酸的质量分数(写出计算过程)。
(4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。

(NH4)2SO4+2NaOH
 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。请计算:
(1)完全反应后产生氨气 g。
(2)该化肥的含氮量为 (精确到0.1%),则这种化肥属于 (填:“合格”或“不合格”。合格硫酸铵含氮量为20%以上)产品。
(3)请计算废硫酸中硫酸的质量分数(写出计算过程)。
(4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。
(1)6.8g (2)20.4% 合格 (3)19.6%
(4)加热反应产生的水蒸汽被废硫酸吸收,导致所测吸收液质量比只吸收氨气大。
(4)加热反应产生的水蒸汽被废硫酸吸收,导致所测吸收液质量比只吸收氨气大。
(1)吸收氨气的溶液增加的质量即为氨气质量,故氨气质量=106.8 g-100 g=6.8 g;(2)6.8 g氨气(NH3)中氮元素的质量即为该化肥中氮元素的质量,即6.8 g×14/17×100%=5.6 g,故该化肥的含氮量为5.6 g/27.5 g×100%≈20.4%>20%,为合格产品。
(3)解:设废硫酸中纯硫酸的质量为x 。
2NH3+H2SO4=(NH4)2SO4,
34 98
6.8g x
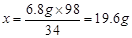
H2SO4%=(19.6g÷100.0g)×100%=19.6%
答:废硫酸中硫酸的质量分数为19.6%。
(3)解:设废硫酸中纯硫酸的质量为x 。
2NH3+H2SO4=(NH4)2SO4,
34 98
6.8g x
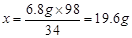
H2SO4%=(19.6g÷100.0g)×100%=19.6%
答:废硫酸中硫酸的质量分数为19.6%。

练习册系列答案
相关题目
 3X+4H2O为动力来源.
3X+4H2O为动力来源.