题目内容
Ⅰ.实验室用30%的双氧水溶液配制100g溶质质量分数为6%的双氧水溶液,需要加入水的体积为 mL。(水的密度为1g/mL)
Ⅱ.某兴趣小组取150克双氧水溶液在3克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为149.8克。试计算:
(1)该实验中生成氧气的物质的量 摩尔。
(2)参加反应的双氧水的物质的量 。(根据化学方程式列式计算)
Ⅱ.某兴趣小组取150克双氧水溶液在3克二氧化锰的作用下反应,反应一段时间后测得容器中剩余物质的总质量为149.8克。试计算:
(1)该实验中生成氧气的物质的量 摩尔。
(2)参加反应的双氧水的物质的量 。(根据化学方程式列式计算)
Ⅰ.80 Ⅱ.0.1 设:需H2O2Xmol
2H2O2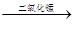 2H2O+O2↑
2H2O+O2↑
2 1
Xmol 0.1mol
2/x=1/0.1
X=0.2 (mol)
2H2O2
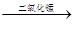 2H2O+O2↑
2H2O+O2↑2 1
Xmol 0.1mol
2/x=1/0.1
X=0.2 (mol)
试题分析:Ⅰ.设需要加入水的体积为x,则100g×6%=(100g-x)×1g/mL×30%,x=80g;Ⅱ.首先根据质量守恒定律计算出反应生成氧气的质量为:150g+3g-149.8g=3.2g,再计算出产生氧气的物质的量为:3.2g÷32g/mol=0.1mol,最后再根据过氧化氢分解成水和氧气的化学方程式,根据生成氧气的物质的量计算出参加反应的过氧化氢的物质的量。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CaO+CO2↑)
CaO+CO2↑) Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?
Si+2CO↑,现要制备含硅14kg的粗硅,理论上可以同时生成一氧化碳的质量是多少?