题目内容
某学生做了如下图所示的实验。
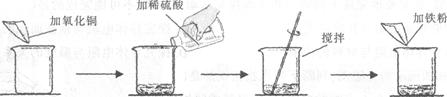
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。

| | 第一次 | 第二次 |
| 加入氧化铜的质量 | m | m |
| 加入稀硫酸的质量 | 50g | 100g |
| 加入铁粉的质量 | 5.6g | 5.6g |
| 实验现象 | 黑色固体和紫红色固体 | 紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为 ;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为 ;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为 。
(1)CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu;
(2)Cu0、Cu、Fe;
(3)56/64 =5.6g/X
(4)8g
(5)7.6%;
(6)80g
(2)Cu0、Cu、Fe;
(3)56/64 =5.6g/X
(4)8g
(5)7.6%;
(6)80g
试题分析:(1)氧化铜与硫酸反应生成硫酸铜和水:CuO+H2SO4=CuSO4+H2O
铁和硫酸铜发生置换反应生成铜和硫酸亚铁:Fe+CuSO4=FeSO4+Cu;
(2)根据表格可知:第二次加入酸的质量为100g时,氧化铜完全反应,铁也是完全反应。那么第一次加入的硫酸不足,即氧化铜没有反应掉,那么铁粉过量,故第一次实验后的固体物质有氧化铜、铜、铁;
(3)第二次实验生成的固体物质是铜,利用化学方程式,根据铁的质量可求出铜的质量。
设生成铜的质量为x;
Fe+CuSO4=FeSO4+Cu
56 64
5.6g X
56/64 =5.6g/X
X=6.4g
(4)利用质量守恒定律化学反应前后元素的质量不变,反应后生成铜的质量为6.4g,设氧化铜的质量为y,则:y× 64/80 ×100% =6.4g
y=8g
(5)设生成的硫酸亚铁的质量为Z,
Fe+CuSO4=FeSO4+Cu
5.6 152
5.6g z
56/152 =5.6g/z
Z=15.2g
反应后溶液的质量=8g+100g+5.6g+92.8g-6.4g=200g
溶质的质量分数=15.2g/200g ×100%=7.6%
(6)设加入的硫酸中溶质的质量为a,
CuO+H2SO4=CuSO4+H2O
80 98
8g a
80/98 =8g/a
a=9.8g
根据溶液稀释前后溶质的质量不变,假设稀释后溶液的质量为b,
49%b=9.8g
b=20g
那么加水的质量=100g-20g=80g

练习册系列答案
相关题目
