题目内容
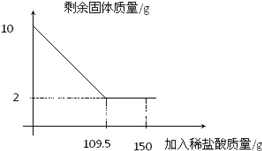
【题目】有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:
(1)赤铁矿中氧化铁的质量分数是 ;
(2)计算所使用的稀盐酸的溶质质量分数。
【答案】解:(1)80%;
(2)设参加反应的盐酸的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
160/8g=219/x
x=10.95g
所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;
【解析】氧化铁和稀盐酸反应生成易溶于水的氯化铁和水,所以反应中固体质量减少,最终不溶的固体是杂质,所以氧化铁的质量为:10g-2g=8g,设所使用的稀盐酸的溶质质量为x,
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
160/8g=219/x
x=10.95g
所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;
答:略

练习册系列答案
相关题目
【题目】下列是我国部分地区人均水量图和水资源紧缺指标表
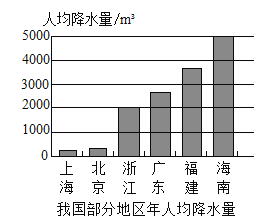
紧缺性 | 人均水量/(m3·ɑ-1)(ɑ,年的符号) |
轻度缺水 | 1700-3000 |
中度缺水 | 1000-1700 |
重度缺水 | 500-1000 |
极度缺水 | <500 |
根据图表分析和你对水资源的认识,请你说说:
(1)图中水资源极度缺水的地区是_____________。
(2)以“保护水资源,刻不容缓”为辩论题,如果你作为正方辩论员,你的辩论要点是(要求从两方面考虑):
①_______________;②___________。