��Ŀ����
����Ŀ����ͭ��һ�ֳ����ĺϽ���ϣ������óɷ�ΪCu��Zn�����������������ᷴӦ�ijɷ֣�����һ�������Ļ�ͭ�м������Ϊ100mL���ܶȦ�=1.2g/mL��ϡ���ᣬ����H2��������������Һ����Ĺ�ϵ��ͼ��ʾ����ַ�Ӧ����Һ��ʣ����������Ϊ27g��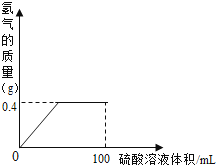
��1���۲�ͼ��ͭ�������ַ�Ӧ�������Ƿ���ʣ�ࣿ��ѡ��ǡ��� ��
��2����ͭ��Zn����������Ϊ���٣�������ʽ���㣬�����ȷ��0.1%��
��3��������Ӧ�����Һ�еμ�26%��BaCl2��Һ��ǡ�ò��ٲ�������ʱ��������BaCl2��Һ400g����ԭ������Һ����������Ϊ���٣�������ʽ���㣬�����ȷ��0.1%��
���𰸡�
��1����
��2��
�⣺����Ʒ��п������Ϊx
Zn+H2SO4�TZnSO4+H2��
65 2
x 0.4g
![]()
x=13g
���Ի�ͭ��Zn����������Ϊ![]() ��100%=32.5%
��100%=32.5%
����ͭ��Zn����������Ϊ32.5%��
��3��
�⣺��ԭ������Һ����������Ϊy
H2SO4����������- BaCl2
98 208
100mL��1.2g/mLxx 400g��26%
![]()
x=40.8%
��ԭ������Һ����������Ϊ40.8%��
����������1��ͨ��ͼ���е����ݿ��Կ���������ϡ������������0.4�˺�����������������ӣ����岻�����ӣ�����������ʣ�ࣻ
��2������Ʒ��п������Ϊx
Zn+H2SO4�TZnSO4+H2��
65 2
x 0.4g![]()
x=13g
���Ի�ͭ��Zn����������Ϊ![]() ��100%=32.5%��
��100%=32.5%��
��3����ԭ������Һ����������Ϊy
H2SO4����������- BaCl2
98 208
100mL��1.2g/mLxx 400g��26%![]()
x=40.8%
���Դ��ǣ���1���ǣ���2��32.5%����3��40.8%��
�����㾫�������ո��ݻ�ѧ��Ӧ����ʽ�ļ����ǽ����ĸ�������Ҫ֪�������ʼ�������=ϵ������Է�������֮�ȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�