题目内容
【题目】如图是甲、乙、丙三种物质的溶解度曲线.回答下列问题:
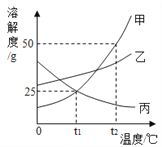
①t1℃时,甲的溶解度为_______;
②现有甲、乙、丙三种物质的浓溶液,适用海水晒盐原理进行结晶提纯的是________;
③t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是___________;
④下列说法正确的是______.
A.t2℃时把50g甲放入50g水中所得到甲的饱和溶液中溶质与溶液的质量比为1:2
B.t2℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
C.t1℃时,甲、乙、丙三种溶液分别升温,其浓度都不可能发生变化
D.t1℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
E.t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,这三种溶液的溶质质量分数的大小关系是乙>甲=丙
F.t1℃时,甲、乙、丙三种溶液的浓度可能相等.
【答案】 50g 乙 降温结晶 D、F
【解析】(1)由溶解度曲线可知,t1℃时,甲的溶解度为50g;(2)海水晒盐原理进行结晶提纯的是乙,因为甲和丙的溶解度受温度的影响比较大,乙的溶解度受温度的影响比较小;(3)t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是降温结晶,因为甲的溶解度随温度的降低而减小,丙的溶解度随着温度的降低而增大; (4) A、t2℃时甲的溶解度为50g,把50g甲放入50g水中所得到甲的饱和溶液中,只能溶解25克甲,故溶质与溶液的质量比为25g:75g=1:3,错误;B、t2℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是丙,因为t2℃时,溶解度是甲>乙>丙,要使等质量的甲、乙、丙完全溶解,丙需要的水最多,错误;C、t1℃时,甲、乙、丙三种溶液分别升温,甲和乙的溶解度增大,溶质和溶剂质量不变,浓度不变,丙的溶解度降低,可能会有晶体析出,也可能没有,其浓度都可能发生变化,错误;D、t1℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为![]() =10%,正确;E、t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,甲析出的晶体较多,溶质质量较少,乙析出的晶体少,溶质质量较大,丙的溶解度增大,但溶质质量最小,故三种溶液的溶质质量分数的大小关系是乙>甲>丙,错误;F、t1℃时,甲、乙、丙三种溶液中溶质质量可能相等,浓度可能相等,正确。故选D、F。
=10%,正确;E、t2℃时,将甲、乙、丙三种物质的饱和溶液降温至t1℃,甲析出的晶体较多,溶质质量较少,乙析出的晶体少,溶质质量较大,丙的溶解度增大,但溶质质量最小,故三种溶液的溶质质量分数的大小关系是乙>甲>丙,错误;F、t1℃时,甲、乙、丙三种溶液中溶质质量可能相等,浓度可能相等,正确。故选D、F。