题目内容
【题目】下列图象与对应实验不符合的是
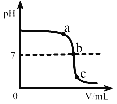
A. 图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸
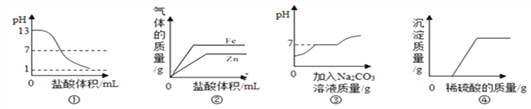
B. 图②表示向等质量的锌、铁粉末中分别滴加足量相同浓度的稀盐酸
C. 图③表示向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液
D. 图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸
【答案】BD
【解析】
A、pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸发生中和反应,生成中性物质,碱性不断减弱至恰好反应时pH=7,再滴加盐酸酸性会不断增强,但不可能达到pH=1,正确;B、等质量的锌、铁与足量的稀盐酸反应,由于横坐标是加入盐酸的体积,斜率应该相同,因为是在金属中滴加相同质量的酸,产生氢气的斜率只和滴加盐酸的速率有关,与图象不一致,错误;C、向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液时,碳酸钠先和稀盐酸反应,溶液酸性减弱,pH升高,恰好完全反应时溶液pH=7, 碳酸钠和氯化钙生成碳酸钙和氯化钠的过程中pH不变,继续加入碳酸钠溶液时,溶液显碱性,pH大于7,正确;D、向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸,一开始就会有硫酸钡沉淀生成,而图象反映的是一开始滴加时无沉淀生成,错误。故选BD。

【题目】一些骗子常用黄铜冒充黄金骗取钱财,某同学通过查阅资料得知黄铜是锌和铜的合金,他取一定量的某黄铜样品放入烧杯中,再向其中分4次加入等质量的同一稀硫酸,每次均充分反应。实验过程中有关物质的用量及质量测定记录如下表:
实验次数 | 1 | 2 | 3 | 4 |
稀硫酸的用量/g | 20 | 20 | 20 | 20 |
剩余固体的质量 | 10 | 8.7 | 7.4 | 7.2 |
分析表中数据,完成下列问题:
(1)所取黄铜样品的质量为___________ g;
(2)第4次实验结束后溶液的pH __________7(填“>”、“=”或“<”);
(3)所用稀硫酸中溶质的质量分数为________________?(要求有解答过程)
【题目】FeCl2溶液中混有少量的CuCl2,为了除去CuCl2,某课外小组同学取该溶液50g于烧杯中,然后等量分5次加入某物质M充分反应,所得数据如下表,请根据相关知识和数据回答下列问题:
次数 | 1 | 2 | 3 | 4 | 5 |
加入M的质量(g) | 0.28g | 0.28g | 0.28g | 0.28g | 0.28g |
溶液的总质量(g) | 49.96 g | 49.92 g | 49.88g | 49.84g | 49.84g |
(1)写出物质M的化学式______.
(2)参加反应M的总质量是________?
(3)FeCl2溶液中CuC12的质量分数是_______?
【题目】中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
(实验过程1)
对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过下图所示实验步骤进行操作。
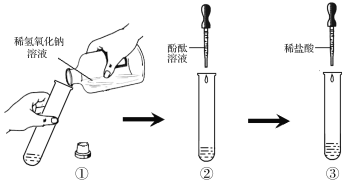
请根据上图所示实验步骤填写实验报告:
实验步骤 | 实验现象 | 实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 | NaOH与HCl 发生了中和反应 | |
②_______________ | ______________ | |
③____________ | ______________ |
(实验过程2)
对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有___的现象,就可以说明中和反应已经发生。该反应的化学方程式为_____。〔提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3〕
(实验反思)
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行(实验过程1)的实验。你认为______(填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是_____。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助_____的变化,来判断是否反应或反应进行的程度。