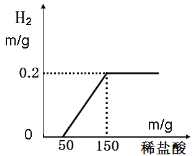
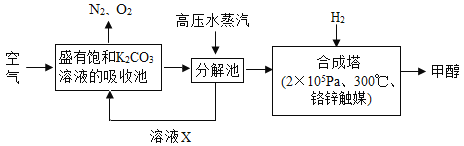
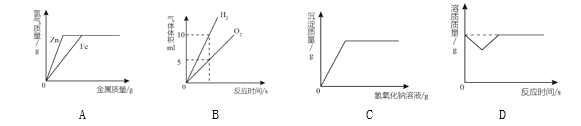
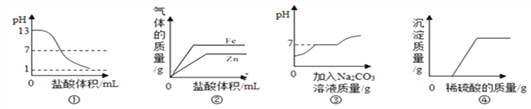
题目内容
【题目】某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液68.0g,加入二氧化锰2.0g,待完全反应不再有气体逸出时,称得得剩余物质的总质量为68.4g。计算:
(1)反应完全后产生氧气的质量是__________g。
(2)该过氧化氢溶液中溶质的质量分数(写出计算过程)___________
【答案】 1.6 5%
【解析】
(1)根据质量守恒定律,生成氧气的质量为68.0g+2.0g-68.4g=1.6g;
(2)设生成1.6g的氧气需要过氧化氢的质量为x
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
![]() =
=![]() ,解得x=3.4g
,解得x=3.4g
该过氧化氢溶液中溶质的质量分数为![]() ×100%=5%
×100%=5%
答:生成氧气的质量为1.6g,该过氧化氢溶液中溶质的质量分数为5%。

练习册系列答案
相关题目