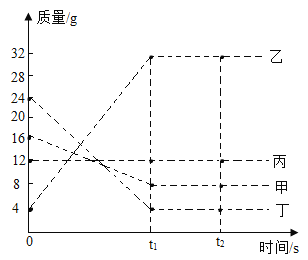
题目内容
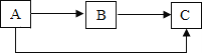
【题目】A—I是初中化学常见的九种物质。其中B为红色固体,E可作为干燥剂,I在溶液中是一种红褐色沉淀,它们相互转化的关系如图14所示(部分反应物、生成物及反应条件已略去)。

请回答下列问题:
(1)I物质的化学式为_______________。
(2)转化⑥的化学方程式为_______________________________________。
(3)反应④的基本反应类型为______________________。
(4)反应⑤在生产生活中的用途是_____________________________。
【答案】Fe(OH)3 ![]() 复分解反应 除铁锈
复分解反应 除铁锈
【解析】
B为红色固体,则B可能是是氧化铁; A与B(氧化铁)反应生成C和D,D又可以转化成A,一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,二氧化碳与碳在高温条件下反应生成一氧化碳,则A是一氧化碳,D是二氧化碳,C是铁;E可作为干燥剂(可能是氧化钙、氢氧化钠、浓硫酸),H又能生成D和E,碳酸钙在高温条件下生成氧化钙和二氧化碳,故E应是氧化钙, H是碳酸钙;I在溶液中是一种红褐色沉淀,则I是氢氧化铁,E能转化为F,F与G反应能生成I(氢氧化铁),B(氧化铁)转化为G再转化为I,氢氧化钙与氯化铁或硫酸铁反应生成氢氧化铁和氯化钙或硫酸钙,则G是氯化铁或硫酸铁,F是氢氧化钙。带入检验,推断合理。
(1)I物质为氢氧化铁,化学式为Fe(OH)3。
(2)转化⑥是氧化钙与水反应生成氢氧化钙,反应的化学方程式为![]() 。
。
(3)反应④可能是氢氧化钙与氯化铁反应生成氢氧化铁沉淀和氯化钙,该反应是两种化合物互相交换成分生成另外两种化合物,属于复分解反应。
(4)反应⑤是氧化铁与盐酸(或硫酸)反应生成氯化铁(或硫酸铁)和水,生活中该反应可用于除铁锈。

【题目】复分解反应存在这样一个规律:较强酸可制取较弱酸。中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应。盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解。
已知在常温下测得浓度均为0.lmol/L的下列6种溶液的pH:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)请根据上述信息判断下列反应不能发生的是_____(填编号)。
A ![]()
B ![]()
C ![]()
D ![]()
E ![]()
F ![]()
(2)一些复分解反应的发生还遵循其他的规律、下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KC1和NaNO3的混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的另一规律为_____。
(3)已知溶液的pH与氢离子浓度有直接关系。物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是_____(填编号)。
①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HC1O ⑤H2SO4
(4)25℃时,M酸溶液的pH=a,N碱溶液的pH=b。若X为强酸,Y为强碱,且![]() ,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。
,若两者等体积混合后,溶液的pH=7.此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是_____。