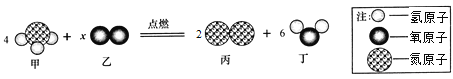
题目内容
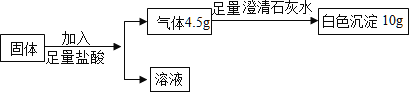
【题目】某固体混合物含有碳酸钙、氧化钙、铁粉中的一种或几种。取该固体粉末 18.4 g,按下列流程进行实验,其中说法正确的是(不考虑盐酸的挥发)
A.生成氢气的质量为 0.2 gB.铁粉的质量为 2.8 g
C.氧化钙的质量为 5.6 gD.溶液中氯化物的质量为 22.2 g
【答案】BC
【解析】
碳酸钙与稀盐酸反应生成的气体为二氧化碳,铁与稀盐酸反应生成的气体为氢气;得到的气体加入足量的澄清石灰水,生成白色沉淀10g,设二氧化碳的质量为x,则
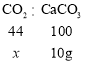
![]()
x=4.4g;
所以生成氢气的质量为:4.5g-4.4g=0.1g;
设铁的质量为y,则
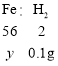
![]()
y=2.8g;
依据碳元素守恒可知,样品中碳酸钙的质量为10g,氯化钙的质量为18.4g-10g-2.8g=5.6g,所以:
A、经计算生成氢气的质量应为 0.1 g,说法错误;
B、铁粉的质量为 2.8 g,说法正确;
C、氧化钙的质量为 5.6 g,说法正确;
D、根据钙元素质量守恒,溶液中氯化钙的质量为![]() ,但溶液中还有剩余的盐酸,故溶液中氯化物的质量大于22.2g,说法错误;
,但溶液中还有剩余的盐酸,故溶液中氯化物的质量大于22.2g,说法错误;
故选:BC。

练习册系列答案
相关题目
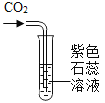
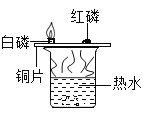
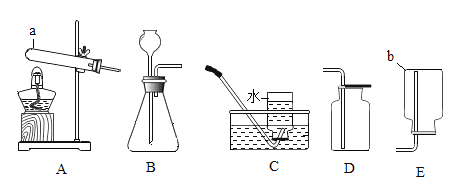
【题目】下列实验设计能达到目的的是
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 证明二氧化碳与水反应生成碳酸 | 证明二氧化碳不可燃、不助燃、密度大于空气 | 证明铁铜银的活动性顺序 | 证明可燃物燃烧需要氧气和温度达到着火点 |
A.AB.BC.CD.D