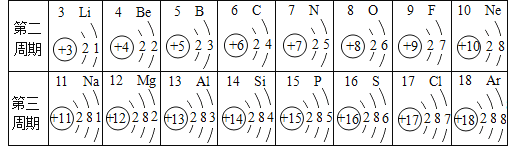
题目内容
【题目】现有A、B、C、D四种没有标签的无色溶液,分别是稀盐酸、碳酸钠溶液、澄清石灰水、氢氧化钠溶液中的一种,为了鉴别它们进行以下实验,实验步骤及现象如下:
(1)先分别取少量的四种溶液样品于洁净的试管中,再分别向四种溶液中滴加适量紫色石蕊溶液,结果A溶液显红色,B、C、D溶液显蓝色。
(2)B、C溶液混合后有白色沉淀产生,根据现象回答下列问题:B和C溶液混合发生反应的化学方程式为____。
(3)物质鉴别完成后,取稀盐酸和氢氧化钠溶液进行实验,如图所示。


请回答以下有关中和反应的问题:
①图1图像表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2____(填“甲”或“乙”)图所示进行的,曲线上A点溶质为__(填化学式)。
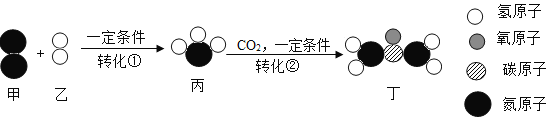
②图3是NaOH溶液与稀盐酸恰好完全反应的微观示意图,若反应后溶液pH为7,图3中缺少的微粒的化学式为____。
③根据乙图进行的实验中,用温度计测出烧杯中溶液的温度变化如图4所示:由图知,稀盐酸与氢氧化钠溶液发生的反应是___(填“放热”或“吸热”) 反应。
【答案】![]() 乙 NaCl、NaOH H2O 放热
乙 NaCl、NaOH H2O 放热
【解析】
石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,稀盐酸、碳酸钠溶液、澄清的石灰水、氢氧化钠溶液分别显酸性、碱性、碱性、碱性。取四种溶液分别滴加石蕊溶液,结果A溶液呈红色,B、C、D溶液呈蓝色,故A为稀盐酸,B、C、D为碳酸钠溶液、澄清的石灰水、氢氧化钠溶液中的一种。酚酞遇碱性溶液变红色,而氢氧化钠溶液呈碱性,氢氧化钠可以和稀盐酸反应生成氯化钠和水。
(2)根据B、C溶液混合后有白色沉淀产生,故B和C分别是碳酸钠和氢氧化钙中的一种,反应为碳酸钠和氢氧化钙反应产生碳酸钙沉淀和氢氧化钠,反应的方程式为![]() 。
。
(3)①由盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化图像可知,开始溶液的pH大于7,溶液显碱性,最终溶液的pH小于7,则是将稀盐酸加入到氢氧化钠溶液中,故进行该反应的实验操作是按照图乙所示进行的。曲线上A点溶液的pH大于7,溶液显碱性,则溶质为生成的氯化钠和没有反应的氢氧化钠,化学式为:NaCl、NaOH。
②氢氧化钠和稀盐酸反应生成氯化钠和水,氯化钠在溶液中以钠离子和氯离子的形式存在,若反应后溶液pH为7,说明氢氧化钠和稀盐酸完全反应,故图3中缺少的微粒是水分子,化学式为:H2O。
③由乙图可知,AB段稀盐酸和氢氧化钠反应,温度升高,故稀盐酸与氢氧化钠溶液发生的反应是放热反应。

 阅读快车系列答案
阅读快车系列答案