题目内容
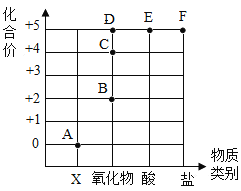
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
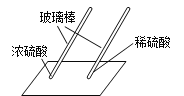
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
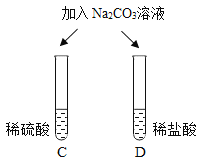
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
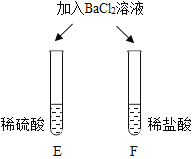
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
【答案】无现象或无明显现象 浓 浓度或溶质质量分数等合理答案 气泡 H 白色沉淀 2HCl+Na2CO3=2NaCl+H2O +CO2↑ BaCO3
【解析】
(1)醋酸晶体不与镁反应,所以无明显现象。
(2)浓硫酸有脱水性,可使纸张炭化。
(3)浓硫酸浓度大,有脱水性。稀硫酸浓度小,无脱水性。由此可看出由于浓度不同,二者的性质不完全相同。
(4)碳酸钠可与稀硫酸、稀盐酸反应,均生成二氧化碳气体,因此都有气泡出现。
(5)酸具有相似的化学性质是因为在酸溶液中都含有大量的氢离子,故酸的组成中都含有:H。
(6)硫酸可与氯化钡反应生成不溶于水的硫酸钡,所以E试管中会出现白色沉淀。
(7)根据上面的实验过程可知,废液中可能含有:Na2CO3、H2SO4、HCl、BaCl2中未完全反应的物质。产生气泡说明废液中含有Na2CO3、HCl。二者反应:2HCl+Na2CO3=2NaCl+H2O +CO2↑
(8)根据上面分析,C中反应后废液含有碳酸钠、硫酸钠,F中没有发生反应,溶液中含有HCl、BaCl2,C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液混合后出现白色沉淀,硫酸钠和氯化钡生成难溶于水及盐酸的硫酸钡,所以白色沉淀中一定含有硫酸钡,但如果废液中含有Na2CO3较多、将盐酸完全反应后还有剩余,碳酸钠和BaCl2也会生成碳酸钡沉淀,所以白色沉淀中还可能有BaCO3。

 名题金卷系列答案
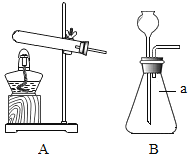
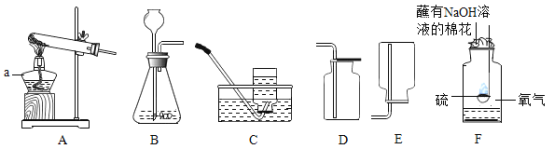
名题金卷系列答案【题目】(1)根据下图的实验装置,回答问题:
发生装置 | 收集装置 | 洗气装置 |
|
|
|
①图B中仪器a的名称_____。
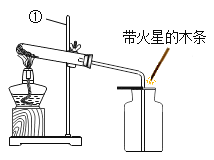
②实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为:_____,发生和收集装置为_____(填字母)。
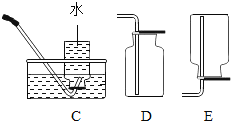
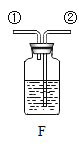
③实验室用石灰石和稀盐酸反应制取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的_____端口(填“①”或“②”)通入,F中发生的化学方程式为_____。
(2)为了探究碱的性质,进行如图所示的实验。

①图甲所示,加入一定量的盐酸后,溶液由红色变为了无色,证明了盐酸和NaOH发生了中和反应,且反应后的溶液中一定没有的溶质是_____。张明对甲实验所得溶液的溶质成分产生了兴趣,对反应后溶液变为无色提出了以下两种猜想:
猜想1:溶质成分只有NaCl;
猜想2:溶质成分为_____。
(进行实验)为了验证自己的猜想正确,张明进行了如下实验,请你和他一起完成下列实验报告:
实验操作 | 实验现象 | 实验结论 |
取少量甲实验所得溶液于试管中,并往试管中加入_____ | 观察到_____ | 猜想2正确 |
②如图乙和丙所示,同时将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后丙中试管内液面高于乙。说明NaOH与CO2发生了反应,该反应的化学方程式为_____。本实验中乙的作用是_____。