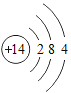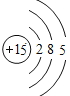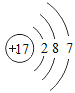题目内容
【题目】甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
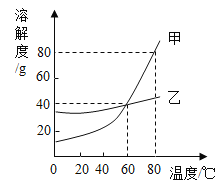
A.80 ℃时,甲的饱和溶液中溶质与溶剂的质量比为 4∶5
B.用蒸发结晶的方法可从乙的饱和溶液中获得大量的乙
C.分别将 60 ℃的甲、乙饱和溶液升温至 80 ℃,此时甲溶液的溶质质量分数最大
D.0℃时,向 140 g 甲饱和溶液中先加 50 g 水,再加 20 g 甲,充分溶解后,溶液仍为饱和状态
【答案】C
【解析】
A、80 ℃时,甲的溶解度为80g,甲的饱和溶液中溶质与溶剂的质量比为80g:100g= 4∶5;故选项正确,但不符合题意;
B、乙物质的溶解度受温度影响较小,甲物质的溶解度受温度影响较大,用蒸发结晶的方法可从乙的饱和溶液中获得大量的乙;故选项正确,但不符合题意;
C、60 ℃时,甲、乙溶解度都为40g,分别将 60 ℃的甲、乙饱和溶液升温至 80 ℃,两者都变为不饱和溶液,但此时两溶液的溶质质量分相等;故选项错误,但符合题意;
D、0℃时,甲的溶解度小于20g,50g水最多溶解固体甲的质量小于10g,则向 140 g 甲饱和溶液中先加 50 g 水,再加 20 g 甲,充分溶解后,有固体甲未溶解,溶液仍为饱和状态;故选项正确,但不符合题意;
故选:C。

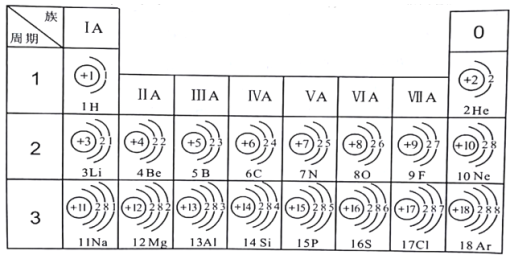
【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
请回答下列问题:
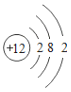
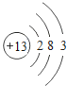
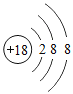
(1)表中硫原子的核电荷数x=_____,在化学反应中容易_____电子。
(2)表中具有相对稳定结构的元素是_____。
(3)写出铝离子的结构示意图_____。
(4)镁元素与氯元素形成的化合物化学式为_____。
(5)上述元素在周期表中处于同一周期的原因是_____。
【题目】小东从海边捡来了一些嵌有沙砾的贝壳(主要成分为碳酸钙),为测定碳酸钙的含量,他做了如下的实验:首先,称取50g贝壳样品,然后将200g盐酸分5次加入(假设杂质均不与盐酸反应,也不溶于水)。实验过程中的数据记录如下表:
稀盐酸的体积/g | 40 | 40 | 40 | 40 | 40 |
剩余固体质量/g | 40.0 | X | 20.0 | 10.0 | 5.0 |
(1)x=_____g
(2)小东测得贝壳样品中碳酸钙的质量分数是_____;
(3)所用盐酸溶质的质量分数为________;(精确到0.1%)
(4)若把生成的二氧化碳收集起来,共有多少克?________________
【题目】某校化学课堂围绕酸、碱的化学性质开展自主探究活动,请你参与学习。
(1)向装有生锈铁钉的试管中加入稀盐酸,观察到铁锈逐渐消失,该反应的化学方程式为_______________。
(2)在进行盐酸中和氢氧化钠溶液实验时,某小组忘记向氢氧化钠溶液中滴加酚酞溶液,因此未观察到明显现象。该小组同学对反应后所得溶液的成分产生疑问。
[假设猜想]针对疑问,第一组同学的猜想如下:
猜想一:只有NaCl;猜想二:有NaCl和HCl;猜想三:有NaCl和NaOH;猜想四:有NaCl、HCl和NaOH。
第二组同学对以上猜想提出质疑,认为有一种猜想是不合理的,指出不合理的猜想并说明原因_____________。
[实验探究]①第三组同学取少量该溶液于试管中,滴加_________溶液,无明显变化,则溶液中一定没有氢氧化钠;
②为验证其余猜想,第四组同学分别取该溶液样品按下列方案探究:
方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 往溶液中加________ | 有气泡产生 | 溶液中有HCl |
方案二 | 往溶液中滴加 AgNO3溶液 | 产生白色沉淀 | 溶液中有HCl |
[得出结论]通过比较分析,猜想二是正确的。
[评价反思]
小明发现,排除不合理猜想后,只做一次实验就能同时验证其余猜想,此实验方法是___________。
[交流讨论]中和反应在日常生活和工农业生产中有广泛应用,请你举一个实例说明:___________。