题目内容
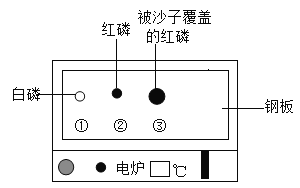
【题目】化学小组用废黄铜粉(铜、锌)和含有硝酸亚铁、硝酸银的废液验证锌、铁、铜、银四种金属活动性顺序,设计如下实验方案:
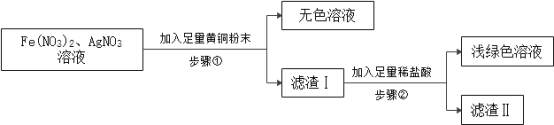
(1)写出步骤①中发生的一个反应的化学方程式_____。
(2)该实验方案能得出锌的金属活动性比铁的强、铁的金属活动性比铜的强,说明判断依据_____。
(3)滤渣Ⅰ中一定含有的成分是_____,滤渣Ⅱ中的成分是_____。设计实验证明滤渣II中金属的活动性顺序,写出实验步骤、现象及结论_____。
【答案】![]() [或
[或![]() ] 步骤①中得到无色溶液,说明铜没有参加反应,铁被置换出来,说明锌的金属活动性比铁的强;步骤②中得到浅绿色溶液,说明铁与稀盐酸反应而铜不能反应,说明铁的金属活动性比铜的强 Fe、Cu、Ag Cu、Ag 向滤渣II中加入硝酸银溶液,溶液变为蓝色,证明铜的金属活动性比银的强
] 步骤①中得到无色溶液,说明铜没有参加反应,铁被置换出来,说明锌的金属活动性比铁的强;步骤②中得到浅绿色溶液,说明铁与稀盐酸反应而铜不能反应,说明铁的金属活动性比铜的强 Fe、Cu、Ag Cu、Ag 向滤渣II中加入硝酸银溶液,溶液变为蓝色,证明铜的金属活动性比银的强
【解析】
(1)步骤①中发生的反应有锌和硝酸银反应生成银和硝酸锌,锌和硝酸亚铁反应生成铁和硝酸锌,故填:![]() [或
[或![]() ]。
]。
(2)该实验方案能得出锌的金属活动性比铁的强、铁的金属活动性比铜的强,判断依据是:步骤①中得到无色溶液,说明铜没有参加反应,铁被置换出来,说明锌的金属活动性比铁的强;步骤②中得到浅绿色溶液,说明铁与稀盐酸反应而铜不能反应,说明铁的金属活动性比铜的强。
故填:步骤①中得到无色溶液,说明铜没有参加反应,铁被置换出来,说明锌的金属活动性比铁的强;步骤②中得到浅绿色溶液,说明铁与稀盐酸反应而铜不能反应,说明铁的金属活动性比铜的强;
(3)步骤①中得到无色溶液,说明铜没有参加反应,银和铁被置换出来,滤渣Ⅰ中一定含有的成分是Fe、Cu、Ag;Fe、Cu、Ag中只有铁与稀盐酸反应,滤渣Ⅱ中的成分是Cu、Ag;向滤渣II中加入硝酸银溶液,溶液变为蓝色,证明铜的金属活动性比银的强。
故填:Fe、Cu、Ag;Cu、Ag;向滤渣II中加入硝酸银溶液,溶液变为蓝色,证明铜的金属活动性比银的强。

 名校课堂系列答案
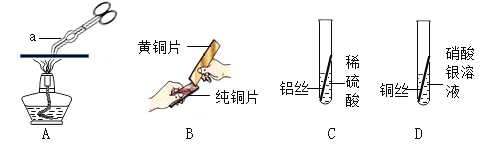
名校课堂系列答案【题目】某化学兴趣小组在老师的帮助下,开展了氢气的燃烧实验的相关探究:
(1)氢气燃烧的化学反应方程式为____________,在氢气点燃之前进行的操作是____________。
(2)作研究氢气的燃烧实验,需用试管收集不同体积比的氢气与空气的混合物,现用正确装置制取氢气,如何用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,写出其操作方法:____________。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静燃烧 | 安静燃烧 | 弱的爆鸣声 | 强的爆鸣声 | 强的爆鸣声 | 弱的爆鸣声 | 不燃烧不爆鸣 |
分析上表信息,你对燃烧条件的新认识是可燃物能否燃烧除具备燃烧条件外,还与____________有关。