题目内容
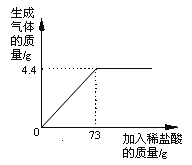
【题目】某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
稀盐酸的质量/g | 15 | 30 | 45 | 60 |
生成气体的质量/g | 1.8 | n | 4.4 | 4.4 |
(1)第Ⅱ组数据n为 g.
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
【答案】(1)3.6g;(2)21.2%
【解析】
试题分析:(1)15g稀盐酸完全反应生成二氧化碳的质量为1.8g,所以30g盐酸完全反应生成二氧化碳质量为3.6g;
(2)根据前两组实验数据分析可知每15克盐酸完全反应生成1.8克二氧化碳,则45克盐酸完全反应应生成5.4克二氧化碳,在第三组实验中加入45克盐酸只生成4.4克二氧化碳,说明第三组实验中盐酸有剩余,碳酸钠反应完,完全反应生成气体的质量为4.4克,设生成4.4g二氧化碳,需要参加反应的碳酸钠的质量为x,则:
Na2CO3 +2HCl=2NaCl+CO2↑+H2O
106 44
x 4.4g
![]()
x=10.6g
混合液中碳酸钠的质量分数是:![]() ×100%=21.2%
×100%=21.2%
答:混合液中碳酸钠的质量分数是21.2%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目