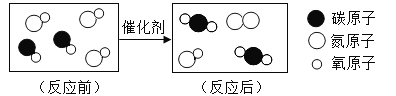
题目内容
【题目】称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题:
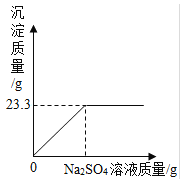
(1)完全反应后生成BaSO4沉淀___________g
(2)恰好完全反应时所得溶液中溶质的质量分数是多少_________?(精确到0.1%,)
【答案】23.3 9.3%
【解析】
(1)由图示可知,生成沉淀的最大量为23.3g,所以完全反应生成硫酸钡沉淀的质量为23.3g;
故答案为:23.3;
(2)设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
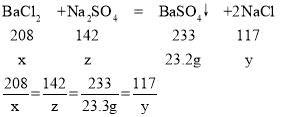
x=20.8g,y=11.7g,z=14.2g
恰好完全反应时加入硫酸钠溶液的质量为:![]() ;
;
恰好完全反应后所得溶液中溶质的质量分数:![]() ×100%=9.3%;
×100%=9.3%;
答:恰好完全反应后所得溶液中溶质的质量分数为9.3%。

【题目】实验室常用的气体制取装置如下。
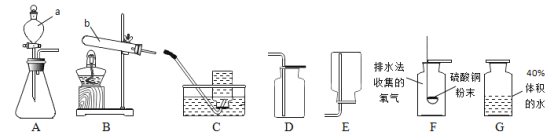
(1)写出编号仪器的名称:a_____,b_____。
(2)选用装置 B 作为制取氧气的发生装置,反应的化学方程式是_____。用D 装置收集氧气,检验氧气集满的方法是_____(写明操作、现象、结论)。
(3)用 C 装置收集一瓶氧气,将盛有白色硫酸铜粉末的燃烧匙伸入该集气瓶中(如图 F 所示),白色粉末变蓝,说明收集到的氧气中含有_____。
(4)某小组同学欲探究不同体积分数的氧气中,带火星木条的复燃情况。
I甲同学欲收集体积分数为 40%的氧气:先将集气瓶中注入 40%体积的水,如上图中 G 所示,然后用排水法收集氧气。乙同学认为该方法得到的氧气体积分数不是 40%,理由是_____。
II改进后继续实验,部分数据如下,可以得出的结论是_____。
氧气体积分数 | 90% | 80% | 70% | 60% | 40% | 30% |
带火星的木条 | 复燃 | 复燃 | 复燃 | 复燃 | 稍亮 | 不变 |
(5)分析上述相关实验结论,写出排水法和向上排空气法收集氧气各自的一个优点。_____
【题目】金属材料在生产、生活中有着广泛的应用。
(1)下列应用中使用金属材料的有_____(填字母)。
|
|
|
|
A、用金、银、铜等制作奖牌 | B、用化学纤维制作毛绒玩具 | C、用新型钢材建造“鸟巢” | D、用聚氯乙烯制造“水立方”外层膜 |
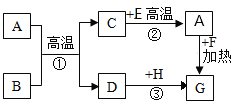
(2)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如图实验方案:
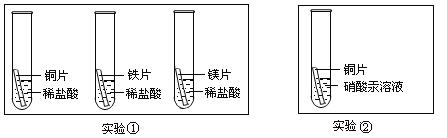
根据实验①判断出镁的金属活动性比铁强,依据的现象是_____,根据实验②的现象得出的结论是_____。
(3)向溶质为AgNO3、Cu(NO3)2、NaNO3的混合物溶液中,加入一定量的镁粉,充分反应后过滤,得到蓝色溶液,则所得蓝色溶液中一定含有的溶质是_____。
(4)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是_____。
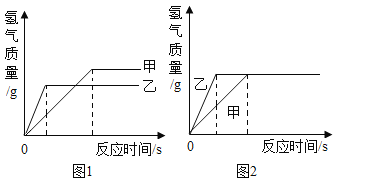
A 甲是锌,乙是铁
B 甲是铁,乙是锌
C 图1中消耗硫酸的质量甲>乙
D 图2中金属乙与硫酸充分反应后,金属乙一定有剩余