题目内容
【题目】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答:
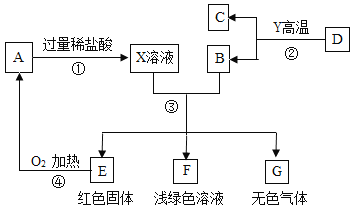
(1)A物质的化学式_____________。
(2)写出反应③中生成红色固体的化学方程式_____________。
(3)上图转化中产生无色气体G的原因是_____________。
(4)C物质在实际生活中的一种用途是_____________。
【答案】CuO Fe+CuCl2=FeCl2+Cu X溶液中过量的稀盐酸与铁反应产生氯化亚铁和氢气 灭火、气体肥料等
【解析】
反应②是炼铁工业中的主要反应,则是铁矿石在高温条件下与一氧化碳反应产生铁和二氧化碳:Fe2O3+3CO![]() 2Fe+3CO2,B属于单质,则是铁,C是二氧化碳气体;E是红色固体铜,F为浅绿色溶液,则一定含有亚铁离子;铜在氧气中加热产生黑色固体氧化铜,则A是氧化铜,氧化铜与稀盐酸反应产生氯化铜和水,X溶液中有氯化铜和过量的稀盐酸,铁与稀盐酸反应产生氯化亚铁和氢气,则G是氢气,铁与氯化铜反应置换反应产生铜和氯化亚铁,则F是氯化亚铁溶液;
2Fe+3CO2,B属于单质,则是铁,C是二氧化碳气体;E是红色固体铜,F为浅绿色溶液,则一定含有亚铁离子;铜在氧气中加热产生黑色固体氧化铜,则A是氧化铜,氧化铜与稀盐酸反应产生氯化铜和水,X溶液中有氯化铜和过量的稀盐酸,铁与稀盐酸反应产生氯化亚铁和氢气,则G是氢气,铁与氯化铜反应置换反应产生铜和氯化亚铁,则F是氯化亚铁溶液;
(1)A物质是氧化铜,化学式:CuO;
(2)反应③铁和氯化铜反应产生铜和氯化亚铁的化学方程式:Fe+CuCl2=FeCl2+Cu;
(3)上图转化中产生氢气的原因是:X溶液中过量的稀盐酸与铁反应产生氯化亚铁和氢气;
(4)C是二氧化碳,二氧化碳物质在实际生活中的一种用途是:二氧化碳没有助燃性,也不能燃烧,可以用来灭火,二氧化碳是光合作用的气体原料,可以用来做气体肥料等。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】硫酸镁晶体(MgSO4﹒7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如下:

已知:部分氢氧化物沉淀时溶液的pH见下表:
物质名称 | Mg(OH)2 | Fe(OH)3 |
开始沉淀 | 9.1 | 1.9 |
完全沉淀 | 11.1 | 3.2 |
(1)“浸取”步骤中,MgCO3 溶于稀硫酸的化学方程式为_______。
(2)“氧化”步骤中,加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是_____________。
(3)“沉淀”步骤中,用氨水调节溶液的pH范围为_______,其目的是________。
(4)“过滤”所得滤液中含有的阳离子为_________(写离子符号)。
(5)“结晶”步骤中需蒸发浓缩滤液,当蒸发皿中_______时 即可停止加热。
【题目】生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 5.8g | 94.6g | 150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为_____ g;
(2)样品中碳的质量分数_____(计算结果保留到0.1%);