题目内容
【题目】如图是实验室制取气体的常用装置,请回答下列问题。
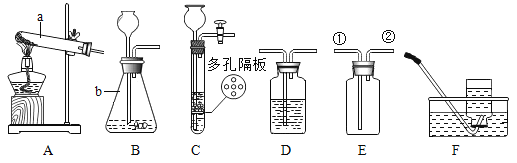
(1)实验室用大理石和稀盐酸反应制取二氧化碳,应选发生和收集装置为__(填写序号)。发生装置G的优点是___。该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的___(填“①”或“②”)口入;
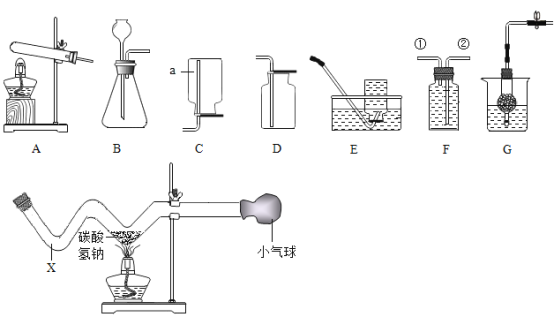
(2)碳酸氢钠加热生成碳酸钠、水、和二氧化碳。为验证碳酸氢钠加热有二氧化碳气体生成,小明用如图装置进行实验。他认为只要观察到小气球膨胀,就能说明生成了二氧化碳。同学们讨论后认为小明依据不充分,原因是______。小红认为在X处预先加入少量澄清石灰水,观察到___,就可证明有二氧化碳生成,也可将澄清石灰水换作____同样能证明;
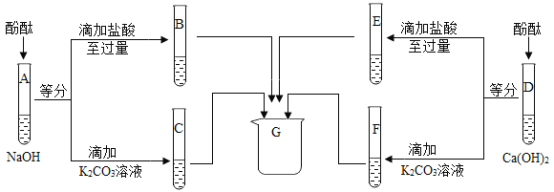
(3)为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。
①A、D中酚酞均变_色,说明两种溶液都呈碱性;
②写出F中沉淀的化学式___;
③四支试管内的物质在G中混合后得到无色溶液,其中一定含有的溶质是__,可能含有的溶质是__。
【答案】BD 可控制反应的发生和停止(或随开随用,随关随停) ② 装置内的空气加热时体积增大,也能使小气球膨胀 澄清石灰水变浑浊 氢氧化钡 红色 CaCO3 NaCl、CaCl2、KCl HCl
【解析】
(1)实验室用大理石和稀盐酸反应制取二氧化碳,反应物是固体和液体,不需要加热,应该用B作为发生装置;
二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
发生装置G的优点是能使反应随时进行或停止,原理:关闭开关时,干燥管中的气体增多,压强增大,把液体压入烧杯,固体和液体分离,反应停止,打开开关时,气体导出,干燥管中的气体减少,压强减小,液体进入干燥管和固体混合,反应进行;
该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,洗气应“长进短出”,这样反应比较充分,则该混合气体应从F装置的②口入;
(2)同学们讨论后认为小明依据不充分,原因是加热时装置中的空气膨胀,导致气球膨胀;小红认为在X处预先加入少量澄清石灰水,观察到澄清石灰水变浑浊,就可证明有二氧化碳生成,也可将澄清石灰水换作氢氧化钡溶液同样能证明,是因为二氧化碳和氢氧化钡反应生成白色沉淀碳酸钡和水,过程中溶液变浑浊;
(3)①A、D中酚酞均变红色,说明两种溶液都呈碱性;
②F中碳酸钾和氢氧化钙反应生成白色沉淀碳酸钙和氢氧化钾,沉淀碳酸钙的化学式是CaCO3;
③B中氢氧化钠与稀盐酸反应生成氯化钠和水,稀盐酸过量,C中含氢氧化钠和碳酸钾;E中氢氧化钙和盐酸反应生成氯化钙和水,稀盐酸过量;F中氢氧化钙和碳酸钾反应生成碳酸钙和氢氧化钾,四支试管内的物质在G中混合后得到无色溶液,说明溶液显中性或显酸性,碳酸钾、氢氧化钾、氢氧化钙已经与稀盐酸发生了反应,且碳酸钙与稀盐酸反应生成了氯化钙、二氧化碳和水,故其中一定含有的溶质是反应生成的氯化钠、氯化钾、氯化钙,可能含有的溶质是过量的氯化氢。

【题目】铁粉中混入了少量的某种盐杂质,为测定混合物中铁粉的质量分数,某小组进行了如下操作:称取7.7g混合物,然后将80 g稀硫酸分四次加入盛装混合物的容器中,测得加入稀硫酸的质量与生成氢气的质量关系如下表。( 盐杂质不与单质铁反应)
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/ g | 20 | 20 | 20 | 20 |
产生氢气的累计质量/g | 0.05 | 0.15 | 0.20 | m |
(1)表中m的值为______;第三次加入的硫酸________(填“被”或“未被")反应完。
(2)计算混合物中铁粉的质量分数是多少?(写出计算过程,结果精确到0.1%)
(3)请根据数据和计算结果,在坐标中画出对应的曲线。
(4)第一次加入稀硫酸时,产生的氢气只有0.05g 的原因可能是________
【题目】将一定质量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。下列判断正确的是 ( )
物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 23 | 40 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 27 | 22 | a |
A.表中a的值为15
B.物质X是该反应的催化剂
C.物质X中可能含有氢元素
D.若起始时增加8g氧气,则无X生成