题目内容
【题目】化学是一门以实验为基础的学科,气体的制备是其中一种重要的实验。现有如下仪器供选。

(实验一)用大理石(或石灰石)和稀盐酸制取CO2。
(1)仪器A的名称是______,仪器F的名称是______。
(2)组装整套装置时,可选用图中的A、B、C、I、J、L、P和______。
(3)组装的装置在加入药品前要检查气密性,方法有多种,下列方法和现象能说明该装置不漏气的是___________(填字母序号填空)。
A.用弹簧夹夹紧橡胶管,向长颈漏斗中加水,长颈漏斗内形成稳定的水柱;
B.向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓拉注射器活塞,长颈漏斗下端冒气泡;
C.向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓推注射器活塞,长颈漏斗中液面上升;
D.将导管浸入水中,双手捂住锥形瓶外壁,观察到导管口没有气泡;
(4)实验室制取CO2气体的化学方程式为____,用向上排空法收集CO2气体验满的操作是____。
(5)选择气体的制取装置时,需要考虑反应物的状态、____和气体的性质。
(实验二)实验室制取O2并进行一系列探究。
〖探究1〗用氯酸钾、二氧化锰为原料制取并收集氧气
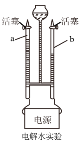
(1)该方法制取氧气的化学方程式为____;能用排水法收集氧气是因为氧气___;选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择上图中的________。
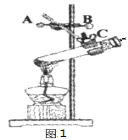
(2)某同学组装了发生装置如图1所示,错误是____,若要改正错误,需要操作的旋钮是____(填字母)。
(3)某小组经实验测定,排水法收集的氧气平均浓度为89.7%,向上排空气法收集的氧气平均浓度为79.7%,对比排水法和向上排空气法,________法收集的氧气更纯净,用向上排空气法收集到的氧气浓度只有80%左右的原因有_______(填字母编号)。
A.氧气的密度略大于空气的密度
B.加热氯酸钾和二氧化锰固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
(4)某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为______。
A.4% B.14.5% C.25.5% D.50%
〖探究2〗对H2O2分解的各种催化剂的催化效果进行定量对比探究
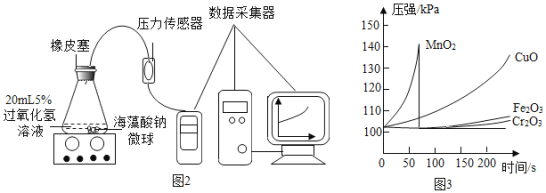
(小资料)海藻酸钠是一种天然高分子物质,在本实验中性质稳定。实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到如图的锥形瓶内压强随时间变化的曲线图。
(1)用双氧水、二氧化锰为原料制取氧气的化学方程式为___,该反应属于___反应(填基本反应类型)。
(2)每次实验时,海藻酸钠微球数应相同的原因_____。
(3)用含MnO2的海藻酸钠微球进行实验,60 s左右时压强瞬间回落,其原因是________。
(4)从实验曲线看,催化效果较好、反应温和的催化剂是________。
【答案】锥形瓶 酒精灯 H ABC CaCO3 + 2 HCl = CaCl2 + H2O + CO2↑ 将燃烧的木条放在集气瓶口,熄灭即满(合理即可) 反应条件 2 KClO3 ![]() 2 KCl + 3 O2↑ 不易溶于水 K 试管口向上倾斜了 AB 排水 ACD B 2 H2O2
2 KCl + 3 O2↑ 不易溶于水 K 试管口向上倾斜了 AB 排水 ACD B 2 H2O2 ![]() 2 H2O + O2↑ 分解 控制催化剂质量相等 反应剧烈,装置内气压过大,使锥形瓶上的橡皮塞弹出 CuO
2 H2O + O2↑ 分解 控制催化剂质量相等 反应剧烈,装置内气压过大,使锥形瓶上的橡皮塞弹出 CuO
【解析】
实验一:
(1)仪器A是锥形瓶,仪器B是酒精灯。
(2)该装置中缺少双孔胶塞,故选H。
(3)A、用弹簧夹夹紧橡胶管,向长颈漏斗中加水,长颈漏斗内形成稳定的水柱,说明装置不漏气,故正确;
B、向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓拉注射器活塞,长颈漏斗下端冒气泡,说明装置不漏气,故正确;
C、向长颈漏斗中注水使下端形成液封,在右侧导管口连接注射器,缓缓推注射器活塞,长颈漏斗中液面上升,说明装置不漏气,故正确;
D、将导管浸入水中,双手捂住锥形瓶外壁,由于长颈漏斗的下端没入液面,故受热膨胀后不会有气体流入烧杯中,故不能观察到导管口有气泡,故不能验证气密性,故错误。故选ABC。
(4)实验室用碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水来制取二氧化碳,该反应的方程式为: CaCO3 + 2 HCl = CaCl2 + H2O + CO2↑。用向上排空法收集CO2气体验满的操作是将燃烧的木条放在集气瓶口,熄灭即满。
(5)选择气体的制取装置时,需要考虑反应物的状态、反应条件和气体的性质
实验二:
(1)氯酸钾在二氧化锰做催化剂的条件下反应生成氯化钾和氧气,反应的方程式为:2 KClO3 ![]() 2 KCl + 3 O2↑。氧气不易溶于水,故可以选排水法收集。选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择图中的K。
2 KCl + 3 O2↑。氧气不易溶于水,故可以选排水法收集。选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择图中的K。
(2)加热固体药品时,试管口要略向下倾斜。选用排水集气法,组装整套装置时,伸入集气瓶口的导管应选择上图中的A和B。
(3)由题可知,用排水法收集的氧气更纯。用向上排空气法收集到的氧气浓度只有80%左右的原因有:A.氧气的密度略大于空气的密度,用向上排空气法收集氧气时可能有部分空气不能排干净,故正确;
B.加热氯酸钾和二氧化锰固体产生气体只有氧气,故氧气的浓度大于80%,故错误;
C.当观察到带火星木条复燃时,集气瓶内还有空气,故正确;
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散使空气不能被排干净,故正确。故选ACD。
(4)用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),则剩余物质为氯酸钾和二氧化锰、氯化钾,而钾元素和氯元素的质量比为39:35.5,则剩余物质中氯元素的质量分数为39.0%×![]() =35.5%;则剩余物质中氧元素的质量分数为1-11.0%-39.0%-35.5%=14.5%.故选B。
=35.5%;则剩余物质中氧元素的质量分数为1-11.0%-39.0%-35.5%=14.5%.故选B。
小资料:
(1)过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应的方程式为:2 H2O2 ![]() 2 H2O + O2↑。该反应是由一种物质反应生成两种物质,故是分解反应。
2 H2O + O2↑。该反应是由一种物质反应生成两种物质,故是分解反应。
(2)根据控制变量法,每次实验时,海藻酸钠微球数应相同的原因控制催化剂质量相等。
(3)用含MnO2的海藻酸钠微球进行实验,60 s左右时压强瞬间回落,其原因是反应剧烈,装置内气压过大,使锥形瓶上的橡皮塞弹出。
(4)由题可知,催化效果较好、反应温和的催化剂是氧化铜。

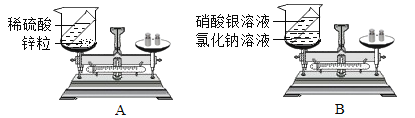
【题目】重庆一中化学兴趣小组的同学用下图所示实验验证质量守恒定律,请你参与其中。
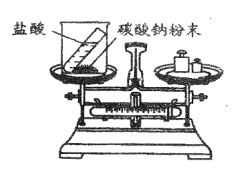
(1)请完善该反应的化学方程式:Na2CO3+ HCl= NaCl + H2O + CO2 ________,若碳酸钠粉末和盐酸恰好完全反应,则烧杯内溶液中所含的微粒有_____________(填微粒符号)。
(2)该实验中,大家进行了两次称量,有四组同学分别得到下列数据,其中有问题的数据是_________(填序号),该反应________(填“遵循”或“不遵循”)质量守恒定律。
① | ② | ③ | ④ | |
反应前称量/g | 75.6 | 73.8 | 74.6 | 76.5 |
反应后称量/g | 75.6 | 70.6 | 71.8 | 77.6 |
(3)为到达验证质量守恒定律的目的,下列改进方法一定可行的是___________(填序号)。

A.将实验试剂换为铁粉和硫酸铜溶液
B.将实验试剂换为二氧化锰和双氧水
C.将天平左盘装置改为如图①所示装置
D.将天平左盘装置改为如图②所示装置
(4)根据该实验得出结论,同学们试剂了如下图所示实验。
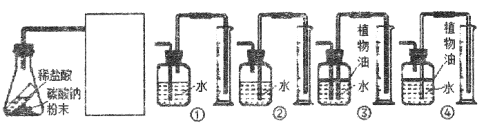
已知二氧化碳能溶于水,则方框内应选择装置_________(填序号)。若反应前锥形瓶内物质总质量为Mg,反应完全后锥形瓶内物质总质量为mg,收集到水的体积为Vml,水的密度为ρ1g/mL,二氧化碳的密度为ρ2g/mL,则可得到的等式是___________(选用含以上字母的式子表示)。