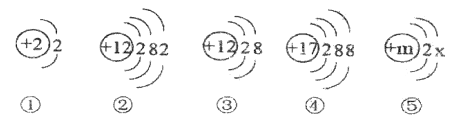
题目内容
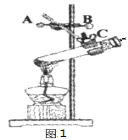
【题目】重庆一中化学兴趣小组的同学用下图所示实验验证质量守恒定律,请你参与其中。
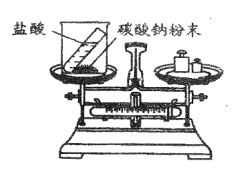
(1)请完善该反应的化学方程式:Na2CO3+ HCl= NaCl + H2O + CO2 ________,若碳酸钠粉末和盐酸恰好完全反应,则烧杯内溶液中所含的微粒有_____________(填微粒符号)。
(2)该实验中,大家进行了两次称量,有四组同学分别得到下列数据,其中有问题的数据是_________(填序号),该反应________(填“遵循”或“不遵循”)质量守恒定律。
① | ② | ③ | ④ | |
反应前称量/g | 75.6 | 73.8 | 74.6 | 76.5 |
反应后称量/g | 75.6 | 70.6 | 71.8 | 77.6 |
(3)为到达验证质量守恒定律的目的,下列改进方法一定可行的是___________(填序号)。

A.将实验试剂换为铁粉和硫酸铜溶液
B.将实验试剂换为二氧化锰和双氧水
C.将天平左盘装置改为如图①所示装置
D.将天平左盘装置改为如图②所示装置
(4)根据该实验得出结论,同学们试剂了如下图所示实验。
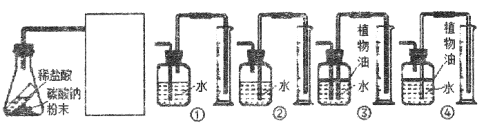
已知二氧化碳能溶于水,则方框内应选择装置_________(填序号)。若反应前锥形瓶内物质总质量为Mg,反应完全后锥形瓶内物质总质量为mg,收集到水的体积为Vml,水的密度为ρ1g/mL,二氧化碳的密度为ρ2g/mL,则可得到的等式是___________(选用含以上字母的式子表示)。
【答案】Na2CO3 + 2HCl ====2NaCl + H2O + CO2↑ Na+、Cl-、H2O ①④ 遵循 ACD ④ M-m=ρ2V
【解析】
(1)根据化学方程书写方法和氯化钠在水中电离进行分析解答;
(2)根据实验现象结合质量守恒定律进行分析;
(3)根据实验装置和试剂间反应生成物进行分析判定;
(4)根据二氧化碳的性质和质量守恒定律进行分析解答。
(1)该反应的化学方程式没有配平,没有标注符号,完善后的化学方程式是:Na2CO3 + 2HCl =2NaCl + H2O + CO2↑;若碳酸钠粉末和盐酸恰好完全反应,则烧杯内溶液中的溶质是氯化钠,溶剂是水,氯化钠在水中能电离出氯离子和钠离子,烧杯内溶液中所含的微粒有Na+、Cl-、H2O;
(2)在该实验中,碳酸钠与盐酸反应后生成二氧化碳逸出,反应后的质量应减小,所以有问题的数据是①④,所有的化学反应都遵循质量守恒定律,所以该反应遵循质量守恒定律;
(3)A、铁与硫酸铜反应生成硫酸亚铁和铜,属于化学反应,能将参加反应的物质质量和生成的物质质量,全部计算在内。将实验试剂换为铁粉和硫酸铜溶液能达到验证质量守恒定律的目的,故A正确;B、双氧水在二氧化锰作用下分解生成水和氧气,氧气逸出,将实验试剂换为二氧化锰和双氧水不能达到验证质量守恒定律的目的,故B错误;C、将天平左盘装置改为如图①所示装置,生成的二氧化碳不能逸出,能达到验证质量守恒定律的目的,故C错误;D、将天平左盘装置改为如图②所示装置,生成的二氧化碳被足量的澄清石灰水吸收不能逸出,能达到验证质量守恒定律的目的,故D正确。故选ACD;
(4)根据题意,方框内应的装置是收集二氧化碳并测量二氧化碳的体积,二氧化碳的密度小于水,二氧化碳能溶于水并与水反应,收集时可用植物油将水与二氧化碳隔离,方框内应选择装置是④;根据装置可知,排出水的体积等于二氧化碳的体积,所以生成二氧化碳的质量=ρ2V,根据质量守恒定律可得到的等式是M-m=ρ2V。

【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
(1)下图A、B、C三个实验用于验证质量守恒定律,
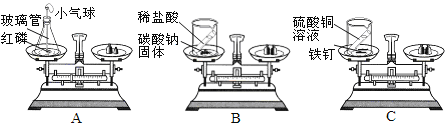
图A中小气球的作用是_________,图C中反应的化学方程式为__________
(2)分别实验后,发现图B不能达到实验目的,原因是___________。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
X的值为______________ ,容器内发生反应的基本类型是_________。