题目内容
【题目】质量守恒定律的发现对化学的发展做出了重要贡献。
①利用下列各组试剂在密闭容器内进行实验,可以验证质量守恒定律的是____(填序号)。
A 蔗糖和水 B 氢氧化钠溶液和硫酸铜溶液 C 白磷和空气
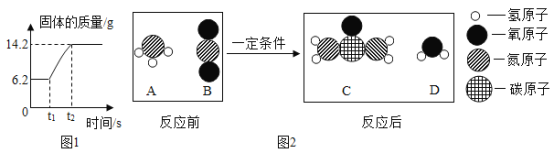
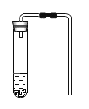
②在氧气中点燃红磷的实验过程,固体质量变化如图1所示,从燃烧条件分析,固体质量在t1前没有发生变化的原因为___,该反应的化学方程式为___,参加反应的氧气的质量为___g。
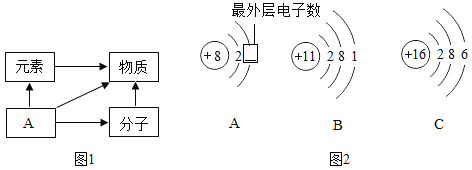
③某反应的微观示意图如图2所示,从微观角度看,图中四种物质都是由____构成,从宏观的角度看,图示物质中属于氧化物的是___(填字母序号),该反应中涉及的元素种类为___种。
④以下应用守恒思想解决相关问题,其中推论正确的是_____。(填序号)
A 50mL36%的盐酸用50mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为18%
B 聚乙烯燃烧生成二氧化碳和水,根据元素守恒推出聚乙烯由碳、氢、氧三种元素组成
C 水电解生成H2和O2的分子数比为2:1,根据原子守恒推出水分子中H、O原子数比为2:1
【答案】BC 温度没有达到红磷的着火点 4P+5O2![]() 2P2O5 8 分子 BD 4 C
2P2O5 8 分子 BD 4 C
【解析】
①A、蔗糖和水是溶解过程,是物理变化,不能直接用于验证质量守恒定律;
B、氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,能直接用于验证质量守恒定律;
C、白磷燃烧有气体参加反应,且产生大量的白烟,验证质量守恒定律,应在密闭容器中进行;
故选BC。
②从燃烧条件分析,固体质量在t1前没有发生变化的原因为温度未达到红磷的着火点;红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5.从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
2P2O5.从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
③由物质的微观构成可知,图中四种物质都是由分子构成;据图可以看出,A是氨气,B表示的是二氧化碳,C是尿素,D表示的是水,二氧化碳和水属于氧化物;该反应中涉及的元素种类为4种。
④A、溶质的质量分数为溶质的质量与溶液的质量之比,然后乘以100%,水的密度为1g/ml,50 mL水的质量为50g,而盐酸的密度大于1g/ml,50mL盐酸的质量不是50g,故稀释后盐酸溶质的质量分数不是18%,故错误;
B、反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素,故根据质量守恒定律,聚乙烯中肯定含有碳、氢两种元素,可能含有氧元素,故错误;
C、根据质量守恒定律,化学反应前后原子的个数不变,反应后氢氧原子个数比为:2:1,故反应前氢氧原子个数比也为2:1,故正确。
答案:①BC;②温度未达到红磷的着火点;4P+5O2![]() 2P2O5;8;③分子;BD;4;④C。
2P2O5;8;③分子;BD;4;④C。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案