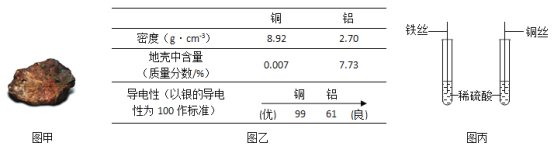
题目内容
【题目】胃液中含有盐酸,常用碳酸氢钠片或铝碳酸镁片治疗胃酸过多症。某化学兴趣小组通过模 拟实验和数字实验探究碳酸氢钠、铝碳酸镁治疗胃酸过多症的优缺点。
(查阅资料)A.铝碳酸镁片主要成分的化学式为[Al2Mg6(OH)16CO3·4H2O] B.抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
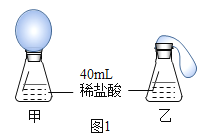
I.(模拟实验) 定性探究碳酸氢钠和铝碳酸镁与“胃酸”的反应 取甲、乙两个大小相同的锥形瓶,瓶内分别加入 40 mL 同浓度的稀盐酸并在瓶口套有相同大小的气球(其中甲瓶气球内放 1.0 g 碳酸氢钠片,乙瓶气球内放 1.0 g 铝碳酸镁片),同时将气球内的 药品放入锥形瓶,充分反应后,现象如图 1 所示。
(1)写出碳酸氢钠治疗胃酸过多的化学方程式:__________ 。
(2)铝碳酸镁治疗胃酸过多时发生的反应为:Al2Mg6(OH)16CO3·4H2O + 18HCl ═ 2X + 6MgCl2 + CO2↑ + 21H2O, 则 X 的化学式为________。铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述化学方程式分析,该药物起抗酸作用的离子是______(填离子符号)。
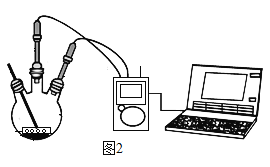
II.(数字实验) 定量探究碳酸氢钠片、铝碳酸镁片与“胃酸”的反应,对比分析两种药片产生CO2的速率快慢和中和酸的能力强弱。取两只 500 mL 规格烧瓶,分别加入 120 mL 稀盐酸并插入 pH 传感器,启动磁力搅拌器和传 感器然后分别投入 1.0 g 碳酸氢钠片和 1.0 g 铝碳酸镁片(如图 2 所示),利用数字化实验分别测 定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生CO2的速率快慢和 pH 的变化,处理所得数据, 得到“二氧化碳浓度-时间”曲线(如图 3 所示)和“pH-时间”曲线(如图 4 所示)。
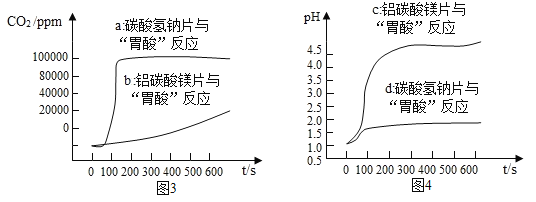
分析曲线图 3、图 4,回答下列问题:
(3)分析图 4,所用稀盐酸的 pH 约为__________;
(4)结合图 3,描述图 1 中乙装置的实验现象是:__________。
(5)相比铝碳酸镁,服用碳酸氢钠治疗更易引发胃胀的原因是:_______。
(6)判断铝碳酸镁片中和酸的能力更强的理由是____________。
(反思与提升)
(7)患有胃溃疡的病人不易过多服用含________ 的药物,以免造成胃胀、引发胃穿孔等症状。 日常生活中,我们应该根据个人的实际病情,遵照医嘱或按药物说明书,选择适合的胃药服用。
【答案】![]() AlCl3
AlCl3 ![]() 、
、![]() 1.0 有气泡产生,气球膨胀缓慢 等质量的铝碳酸镁和碳酸氢钠和盐酸反应,碳酸氢钠产生的二氧化碳气体多 等质量的铝碳酸镁和碳酸氢钠和盐酸反应,铝碳酸镁消耗的盐酸多 碳酸氢钠
1.0 有气泡产生,气球膨胀缓慢 等质量的铝碳酸镁和碳酸氢钠和盐酸反应,碳酸氢钠产生的二氧化碳气体多 等质量的铝碳酸镁和碳酸氢钠和盐酸反应,铝碳酸镁消耗的盐酸多 碳酸氢钠
【解析】
(1)碳酸氢钠治疗胃酸过多,碳酸氢钠与盐酸反应,生成氯化钠、水和二氧化碳气体,化学方程式为![]() 。
。
(2)铝碳酸镁治疗胃酸过多时发生的反应为: Al2Mg6(OH)16CO3·4H2O + 18HCl ═ 2X + 6MgCl2 + CO2↑ + 21H2O,根据反应中原子种类和数目不变,该反应前后镁、氢、氧和碳元素的原子个数相等,则 X 中不含镁、氢、氧和碳元素,而反应后,铝原子个数少了2个,氯原子少6个,则X的化学式为AlCl3。铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子,其中氢氧根离子与氢离子作用生成水分子,碳酸根离子与氢离子作用生成二氧化碳分子和水分子。故该药物起抗酸作用的离子是![]() 、
、![]() 。
。
(3)由图 4可知,反应前所用稀盐酸的 pH 约为1.0;
(4)由图 3可知,等质量的铝碳酸镁和碳酸氢钠和盐酸反应,铝碳酸镁产生的二氧化碳气体较少,故图 1 中乙装置的实验现象是:有气泡产生,气球膨胀缓慢。
(5)由图 3可知,等质量的铝碳酸镁和碳酸氢钠和盐酸反应,碳酸氢钠产生的二氧化碳气体较多,故服用碳酸氢钠治疗更易引发胃胀。
(6)由图 4可知,等质量的铝碳酸镁和碳酸氢钠和盐酸反应,溶液的pH增大较多,溶液酸性变弱较大,说明铝碳酸镁片中和酸的能力更强。
(7)患有胃溃疡的病人不易过多服用含碳酸氢钠的药物,以免产生较多的二氧化碳气体造成胃胀、引发胃穿孔等症状。

 阅读快车系列答案
阅读快车系列答案【题目】下列表格中的叙述、对应反应的化学方程式和所属的基本反应类型都正确的是
选项 | 叙述 | 化学反应方程式 | 反应类型 |
A | 酸雨的形成 | CO2 + H2O ═ H2CO3 | 化合反应 |
B | 溶洞的形成 | Ca(HCO3)2 ═ CaCO3 + H2O + CO2↑ | 分解反应 |
C | 氢氧化钠溶液吸收 SO2 气体 | 2NaOH + SO2 ═ Na2SO3 + H2O | 复分解反应 |
D | 铜和硝酸银溶液反应生成银树 | Cu + 2AgNO3 ═ Cu(NO3) 2 + 2Ag | 置换反应 |
A.AB.BC.CD.D