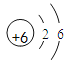题目内容
【题目】小美有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是 25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量(克) | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量(克) | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是_____克。
(2)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)________
(3)第4次加入盐酸充分反应后,溶液中的溶质是_____(填化学式)。
【答案】23.00 7.3% ZnCl2和HCl
【解析】
(1)根据前三次加入10.00g稀盐酸固体减少都是0.65g,而第四次只减少了0.05g,说明已经完全反应,剩余的是银。所以银的质量为23.00g;
(2)根据实验可知,每10g稀盐酸与0.65g的锌恰好完全反应;
设:所用稀盐酸中溶质的质量分数为x。
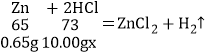
![]() x=7.3%;
x=7.3%;
(3)第4次加入盐酸充分反应后,由于稀盐酸已经过量,所以溶液中的溶质是生成的ZnCl2和剩余的HCl。
答:(1)手镯中银的质量是23.00克。
(2)所用稀盐酸中溶质的质量分数是 7.3%。
(3)第4次加入盐酸充分反应后,溶液中的溶质是ZnCl2和HCl。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目