��Ŀ����
����Ŀ��ʵ����Ҫ����100g������������Ϊ10%���Ȼ�����Һ��
��1�����Ȼ��Ƶ�����Ϊ_____g������ʱӦѡ��_____��ѡ����10����50������100����mL����Ͳ��ȡ����ˮ�������
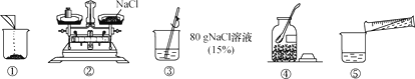
��2��ijͬѧ����ͼ��ʾ�������β�����

���ϲ����лᵼ���Ȼ�����Һ��������������ƫ�͵IJ�����_____������ĸ��ţ���
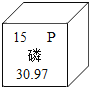
��3������E���ò��������裬��Ŀ����_____��
��4��������20%���Ȼ�����Һ��ˮ����������Һ����Ҫ20%���Ȼ�����Һ������_____g��
���𰸡�10g 100 AB �����ܽ����� 50
��������
��1��������������Һ���������������������������Ȼ��Ƶ�����Ϊ100g��10%��10g����Ҫˮ�������90mL����Ͳʹ��Ӧ�ò��þͽ�ԭ����������ʱӦѡ��100mL����Ͳ��ȡ����ˮ�������
��2�����ƹ����У��ᵼ����Һ������������ƫС����������ȡ��ˮ���ˣ��������Ȼ������ˣ��������ϲ����лᵼ���Ȼ�����Һ��������������ƫ�͵IJ�����AB��
��3�����ܽ�����У��ò��������裬Ŀ���ǣ������ܽ����ʣ�
��4����Һϡ��ǰ�������������䣬���У�![]() ��
��

 ��������������������ϵ�д�
��������������������ϵ�д�����Ŀ��С����һֻ����������п�Ͻ𣩣�������ʵ��̽�����������ĺ��������õ��ӳӳƵ������������� 25.00�ˣ�����ϡ����ֶ�����������ַ�Ӧ��ʵ���������±���
��1�� | ��2�� | ��3�� | ��4�� | ��5�� | |
����ϡ������������ˣ� | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
��ַ�Ӧ��ʣ�������������ˣ� | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
�����ϱ������ݷ���������������⣺
��1������������������_____�ˡ�
��2������ϡ���������ʵ����������Ƕ��٣���д��������̣�________
��3����4�μ��������ַ�Ӧ����Һ�е�������_____���ѧʽ����