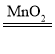题目内容
【题目】某厂生产的纯碱中含有少量氯化钠。取12 g该样品于烧杯中,并滴加稀盐酸至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g。请计算:
(1)产生二氧化碳气体的质量是________g;
(2)反应后溶液中溶质的质量分数________
【答案】4.4 16.3%
【解析】
(1)根据质量守恒定律,产生二氧化碳气体的质量为:12 g+73g-80.6g=4.4g。
(2)设反应生成氯化钠的质量为x,样品中碳酸钠的质量为y。
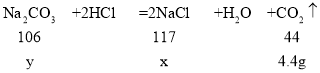
![]() ,
,![]() ,解得x=11.7g,y= 10.6g
,解得x=11.7g,y= 10.6g
则样品中含有氯化钠的质量为:12 g- 10.6g=1.4g
反应后溶液中溶质的质量为:11.7g+1.4g=13.1g
反应后溶液中溶质的质量分数为:![]() ≈16.3%
≈16.3%
答:(1)产生二氧化碳气体的质量是4.4g;
(2)反应后溶液中溶质的质量分数为16.3%。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】“HDPE”膜广泛应用于环保、水利等工程的防渗施工中。老师告诉同学们“HDPE”膜具有极好的抗冲击性和防潮性,火神山医院在建造过程中也用到了“HDPE”膜。听完老师的介绍,同学们对“HDPE”的组成元素产生了兴趣,设计并进行了如下探究。
(提出问题)“HDPE”由什么元素组成?
(查阅资料)①“HDPE”能够燃烧,燃烧可能生成一氧化碳;
②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
(实验探究)如图所示,先通入干燥的氮气,再将4.2g的“HDPE”样品(不含杂质)在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D(装置中每步反应均进行完全)。
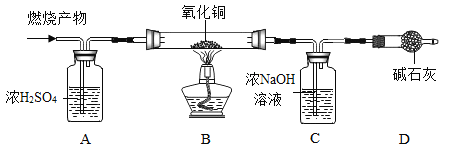
(实验记录)
装置质量 | A 装置总质量 | C 装置总质量 |
实验前 | 100.0g | 100.0g |
实验后 | 105.4g | 113.2g |
(实验分析)
(1)装置A的作用是_____。
(2)实验中观察到装置B中黑色粉末变成红色,写出该装置中发生的化学反应方程式_____。
(3)实验完毕后,先停止加热,继续通入氮气直至玻璃管冷却至室温。继续通入氮气的目的之一是_____。
(实验结论)
(4)根据实验所得数据,分析可知“HDPE”中一定含_____(填元素名称)。
(反思拓展)
(5)实验中的4.2g“HDPE ”样品燃烧消耗的氧气质量为m,则m的取值范围为_____。
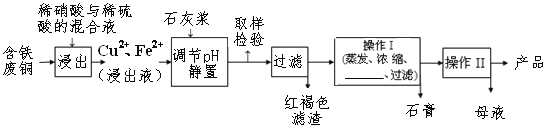
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)石灰浆调pH大约要调节到__________
A. 2 B. 5 C. 7 D.10
(3)含铁的废铜和稀硫酸反应的化学方程式________________________________;
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、__________、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_________________。