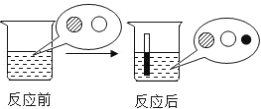
题目内容
【题目】我国大部分地区深受酸雨危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3)。
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色。
(1)酸雨是pH小于______的降雨。
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,化学方程式为_______
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式______
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液的中盐成分进行如何探究:
[提出猜想]反应后的混合溶液中盐的成份是什么?
[进行猜想]猜想1:只有K2SO3
猜想2:__________
猜想3:既有K2SO4,也有K2SO3
[实验探究]限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
实验操作 | 实验现象 | 结论 | |
1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | 猜想3成立 | |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | _____ | |
3 | 向B试管中,加入_____,再加入足量的_____ | 先有白色沉淀,后有气泡产生,沉淀部分溶解, |
反思与拓展:证明混合溶液中的K2SO4的化学反应方程式为________
【答案】5.6 ![]() Na2SO3 +2HCl=2NaCl+H2O+SO2↑ 只有K2SO4 有气泡产生,品红溶液逐渐褪色 BaCl2 HCl K2SO4+ BaCl2=BaSO4↓+2KCl
Na2SO3 +2HCl=2NaCl+H2O+SO2↑ 只有K2SO4 有气泡产生,品红溶液逐渐褪色 BaCl2 HCl K2SO4+ BaCl2=BaSO4↓+2KCl
【解析】
(1)酸雨是pH小于5.6的降雨;
(2)根据题意可知,高温条件下,氧化钙和二氧化硫、氧气反应能生成硫酸钙,反应的化学方程式为:![]()
(3)亚硫酸钠和稀盐酸反应能生成氯化钠、水和二氧化硫,反应的化学方程式为Na2SO3+2HCl═2NaCl+H2O+SO2↑;
进行猜想:
如果酸雨中只含有亚硫酸,则混合溶液的中盐成分是亚硫酸钾,如果酸雨中只含有硫酸,混合溶液的中盐成分是硫酸钾,如果酸雨中含有亚硫酸和硫酸,则混合溶液的中盐成分是亚硫酸钾和硫酸钾。故填只有K2SO4;
实验探究:
2、如果猜想3成立。溶液中含有亚硫酸钾和硫酸钾,向A试管中滴加足量的稀硫酸时,稀硫酸和亚硫酸钾反应生成硫酸钾、水和二氧化硫,二氧化硫能使品红溶液褪色,观察到的实验现象是:有气泡产生,品红溶液褪色;
3、如果猜想3成立。溶液中含有亚硫酸钾和硫酸钾,向B试管中,加入足量的氯化钡溶液,再加入足量的稀盐酸,如果先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有亚硫酸钾和硫酸钾,因为加入足量的氯化钡溶液后,亚硫酸钾和氯化钡反应生成亚硫酸钡沉淀和氯化钾,硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,再加入足量的稀盐酸时,稀盐酸能和亚硫酸钡反应生成硝酸钡、水和二氧化硫,硫酸钡不能和稀盐酸反应;
反思与拓展:氯化钡溶液与硫酸钾反应生成硫酸钡和氯化钾,证明混合溶液中的K2SO4的化学反应方程式为:K2SO4+ BaCl2=BaSO4↓+2KCl。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
A | B | C | D |
加水稀释氢氧化钠溶液 | 一定量的稀硫酸与镁条反应,溶液的质量与反应时间的关系 | 向两份完全相同的稀盐酸中分别加入足量铁粉、镁粉 | 等体积、等质量分数的过氧化氢溶液制取氧气 |
|
|
|
|
A. A B. B C. C D. D