题目内容
【题目】氢化钙(CaH2)常温下能与水反应生成H2和一种碱,是野外工作人员便携燃料的来源。现利用锌粒和盐酸制备H2与金属钙反应制取CaH2(如图,装置左侧连气体发生装置)。则洗气瓶中m、n应选下列试剂的_____、_____(填序号)。
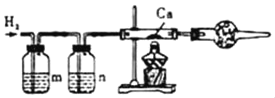
I.NaHCO3溶液 Ⅱ.NaOH溶液 Ⅲ.浓硫酸。
为防止钙被氧化,在点燃之前必须进行的操作是_____。CaH2与水反应的化学方程式为_____,为防止空气中的O2、CO2、水蒸气与Ca或CaH2反应,必须在导管末端连接的干燥管装置中添加的药品是_____(填序号)
A NaOH和CaO的混合物 B 浓硫酸 C 铁粉
【答案】Ⅱ Ⅲ 先通氢气 CaH2+2H2O=Ca(OH)2+2H2↑ AC
【解析】
锌粒和盐酸制备H2的过程中会在氢气中混入氯化氢气体和水蒸气,所以洗气瓶中m、n应分别选试剂:NaOH溶液和浓硫酸,用于吸收氢气中混有的氯化氢气体和水蒸气,故填:Ⅱ、Ⅲ;
为防止钙被氧化,在加热钙之前必须进行的操作是先通氢气,故填:先通氢气;
CaH2与水反应生成氢氧化钙和氢气,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,故填:CaH2+2H2O=Ca(OH)2+2H2↑;
为防止空气中的O2、CO2水蒸气与装璃管中Ca或CaH2反应,必须在导管末端再连接的装置是:装有碱石灰和铁粉的球形干燥管,故填:AC。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】某学习小组在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液,(如图所示),经实验员分析可知原瓶溶液中的溶质可能是 NaHCO3,NaOH,Na2CO3,NaCl中的一种,请你对该试剂作出猜想并进行实验探究:
(提出问题)这瓶试剂是什么溶液?
(猜想与假设)
甲猜想:NaHCO3溶液
乙猜想:NaOH溶液
丙猜想:Na2CO3溶液
丁猜想:NaCl溶液
(查阅资料)上述四种物质相关信息如下
物质 | NaHCO3 | NaOH | Na2CO3 | NaCl |
常温下溶解度/g | 9.6 | 109 | 21.5 | 36 |
常温下稀溶液的pH | 9 | 13 | 11 | 7 |
(实验探究1)取瓶中溶液少许于试管中,滴加几滴酚酞溶液,溶液变红。
(实验探究2)另取瓶中溶液少许于试管中,滴加足量的稀盐酸,产生生气泡。
(实验分析)通过(实验探究1)可知_____同学的猜想一定错误。
甲同学仔细分析四种物质的相关信息表后发现自已的猜想错误,他的理由是_____。
丙同学分析(实验探究2)并结合以上同学的实验结论,认为原瓶溶液是NaCO3溶液。
(实验探究2)中发生反应的化学方程式为_____。
(讨论质疑)乙认为以上同学分析有漏洞,需要进一步实验确定,于是又进行了如下探究。
(实验探究3)在(实验探究1)试管中的红色溶液中滴加过量氯化钙溶液(中性),充分反应后,试管中溶液仍呈红色,但有白色沉淀产生。
(得出结论)通过(实验探究3)可证明这瓶试剂为_____溶液,但已经部分变质。
(反思与拓展)学习小组反思了这瓶试剂因为_____而变质,得出了该溶液正确的保存方法,若要除去该溶液变质部分所采用的方法是_____(用化学反应方程式表示)。

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
产品原理:该厂采用“侯氏制碱法”生产化工产品﹣﹣纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为:_____;后分离出NaHCO3,加热制得纯碱.
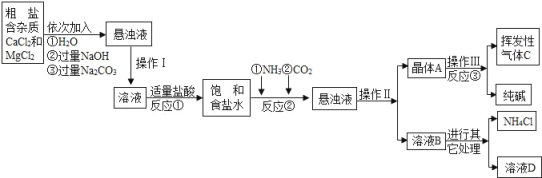
生产流程:
相关资料:
(1)NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
问题讨论:
(1)操作Ⅰ、Ⅱ中,相同操作的名称为_____.反应①中发生了两个反应,写出其中一个化学方程式:_____,反应①加适量的盐酸,适量是指_____.
(2)检验挥发性气体C的方法_____.
(3)上述生产流程中可循环使用的是_____(填序号).
A挥发性气体C; B溶液D; C氢氧化镁;D化肥NH4Cl
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质_____(写化学式).
含量测定:
实验一 | 实验二 | 实验三 | 实验四 | |
固体混合物溶液质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
生成的沉淀的质量 | 4g | m | 10g | 10g |
称取该纯碱样品44g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
(1)m=_____g;
(2)在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?_____(要求写计算过程,结果保留0.1%)
总结反思:
请通过计算并结合下表判断此纯碱样品等级为_____品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小.
工业纯碱标准:(Na2CO3% ) | |||
优等品 | 一等品 | 合格品 | 次品 |
≥95 | ≥80 | ≥75 | ≤40 |
【题目】我国大部分地区深受酸雨危害,煤燃烧产生的SO2是形成酸雨的主要污染物,SO2与水结合生成弱酸性亚硫酸(H2SO3)。
已知:H2SO3易分解生成水和SO2,也易与空气中的氧气或稀硝酸反应生成H2SO4;H2SO3和SO2都能使红色的品红溶液褪色。
(1)酸雨是pH小于______的降雨。
(2)常用脱硫方法减少废气中的SO2,以生石灰(CaO)为脱硫剂,高温下与废气中的SO2与O2化合生成CaSO4,化学方程式为_______
(3)实验室常用亚硫酸盐与HCl或H2SO4反应制备SO2,Na2SO3与盐酸反应的化学方程式______
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(pH约为3)中加入足量的KOH,并就反应后混合溶液的中盐成分进行如何探究:
[提出猜想]反应后的混合溶液中盐的成份是什么?
[进行猜想]猜想1:只有K2SO3
猜想2:__________
猜想3:既有K2SO4,也有K2SO3
[实验探究]限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
实验操作 | 实验现象 | 结论 | |
1 | 各取2mL反应后的混合溶液分别加入A、B两只试管 | 猜想3成立 | |
2 | 向A试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 | _____ | |
3 | 向B试管中,加入_____,再加入足量的_____ | 先有白色沉淀,后有气泡产生,沉淀部分溶解, |
反思与拓展:证明混合溶液中的K2SO4的化学反应方程式为________