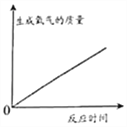
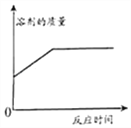
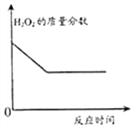
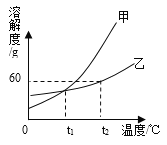
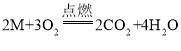题目内容
【题目】实验室为了研究稀盐酸的化学性质,按图进行实验。
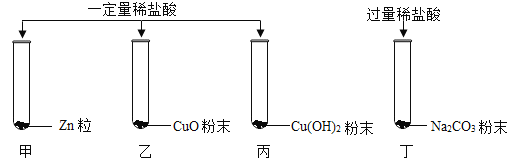
实验后将甲、乙、丙试管中的剩余物倒入一个烧杯中,充分反应。然后将丁实验的剩余物倒入此烧杯中,有气泡冒出。下列说法正确的是
①气泡可能是Na2CO3与稀盐酸反应生成的
② 甲、乙、丙试管混合时有红色物质出现
③ 乙、丙试管中不一定有剩余的稀盐酸
④最后烧杯中的溶液一定含有NaCl、ZnCl2、HCl
A.①②③④B.②③④C.④D.②③
【答案】D
【解析】
①由于丁中稀盐酸过量,Na2CO3完全反应,气泡一定不是Na2CO3与稀盐酸反应生成的,故错误;
②将丁实验的剩余物倒入此烧杯中,有气泡冒出,是甲中锌粒剩余,与稀盐酸反应生成了氢气,由于乙和丙中有反应生成的氯化铜溶液,则甲、乙、丙试管混合时锌和氯化铜反应生成铜,会观察到红色物质出现,故正确;
③丁中稀盐酸过量,则乙、丙试管中不一定有剩余的稀盐酸,故正确;
④最后烧杯中的溶液一定含有碳酸钠和稀盐酸反应生成的NaCl、锌和稀盐酸反应生成的ZnCl2,若盐酸剩余,则一定存在氯化铜,故错误。
故选D

 阅读快车系列答案
阅读快车系列答案【题目】“HDPE”膜广泛应用于环保、水利等工程的防渗施工中。老师告诉同学们“HDPE”膜具有极好的抗冲击性和防潮性,火神山医院在建造过程中也用到了“HDPE”膜。听完老师的介绍,同学们对“HDPE”的组成元素产生了兴趣,设计并进行了如下探究。
(提出问题)“HDPE”由什么元素组成?
(查阅资料)①“HDPE”能够燃烧,燃烧可能生成一氧化碳;
②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
(实验探究)如图所示,先通入干燥的氮气,再将4.2g的“HDPE”样品(不含杂质)在一定质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D(装置中每步反应均进行完全)。
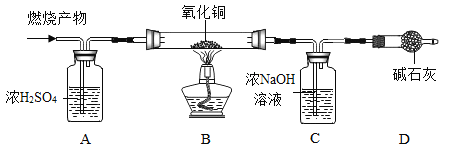
(实验记录)
装置质量 | A 装置总质量 | C 装置总质量 |
实验前 | 100.0g | 100.0g |
实验后 | 105.4g | 113.2g |
(实验分析)
(1)装置A的作用是_____。
(2)实验中观察到装置B中黑色粉末变成红色,写出该装置中发生的化学反应方程式_____。
(3)实验完毕后,先停止加热,继续通入氮气直至玻璃管冷却至室温。继续通入氮气的目的之一是_____。
(实验结论)
(4)根据实验所得数据,分析可知“HDPE”中一定含_____(填元素名称)。
(反思拓展)
(5)实验中的4.2g“HDPE ”样品燃烧消耗的氧气质量为m,则m的取值范围为_____。