题目内容
有一种工业废水,其中含有大量的硫酸亚铁,少量的铜离子以及污泥.某同学设计了一个既经济又合理的方法回收铜和硫酸亚铁晶体.方案流程如图: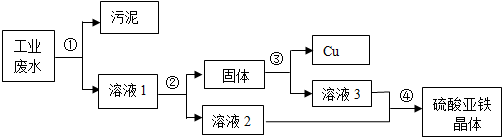
回答下列问题:
(1)步骤②中:需加入的物质是 .
(2)步骤③中:需加入的物质是 ,发生反应的化学方程式是 .
(3)某同学认为经过步骤②后所得固体就是纯净的铜,不需要进行步骤③,你认为是否合理? ,理由是
(4)为了达到资源综合利用的目的,把溶液2和溶液3合并后,经加热浓缩、 、 等操作得到硫酸亚铁晶体.

回答下列问题:
(1)步骤②中:需加入的物质是
(2)步骤③中:需加入的物质是
(3)某同学认为经过步骤②后所得固体就是纯净的铜,不需要进行步骤③,你认为是否合理?
(4)为了达到资源综合利用的目的,把溶液2和溶液3合并后,经加热浓缩、
考点:金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:过滤分离不溶性固体与液体,将废水中的污泥与溶液用过滤法分离,得溶液1中含有硫酸铜和硫酸亚铁,加入过量的铁将硫酸铜中的铜全部置换出来,过滤得到铜和铁的混合物和滤液硫酸亚铁,然后在固体混合物中加入适量硫酸与铁反应生成硫酸亚铁溶液,最后将硫酸亚铁溶液蒸发结晶即得硫酸亚铁晶体.
解答:解:
步骤①是将污泥与溶液分离,故可用过滤,过滤操作中用到的玻璃仪器是 烧杯、漏斗、玻璃棒.
要将硫酸铜与硫酸亚铁的混合溶液中回收铜,同时得到硫酸亚铁溶液,步骤②中只能加入过量的铁置换硫酸铜溶液中的铜.
铁与硫酸铜反应生成铜和硫酸亚铁,因此经过步骤②之后得到的固体中含有生成的铜和剩余的铁,步骤③中加入适量稀硫酸与铁反应生成硫酸亚铁,最后将溶液2和3合在一起进行蒸发结晶即可得到硫酸亚铁晶体.故:
(1)步骤②中:需加入的物质是过量的铁置换硫酸铜溶液中的铜.
(2)步骤③中:需加入的物质是稀硫酸与铁反应生成硫酸亚铁,发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑;
(3)某同学认为经过步骤②后所得固体就是纯净的铜,不需要进行步骤③,此不合理;因为要使Cu2+完全置换出来,必须加入过量的铁;
(4)为了达到资源综合利用的目的,把溶液2和溶液3合并后,经加热浓缩、结晶;过滤等操作得到硫酸亚铁晶体.
故答案为:
(1)Fe;(2)稀硫酸;Fe+H2SO4=FeSO4+H2↑;
(3)不合理;因为要使Cu2+完全置换出来,必须加入过量的铁; (4)结晶;过滤
步骤①是将污泥与溶液分离,故可用过滤,过滤操作中用到的玻璃仪器是 烧杯、漏斗、玻璃棒.
要将硫酸铜与硫酸亚铁的混合溶液中回收铜,同时得到硫酸亚铁溶液,步骤②中只能加入过量的铁置换硫酸铜溶液中的铜.
铁与硫酸铜反应生成铜和硫酸亚铁,因此经过步骤②之后得到的固体中含有生成的铜和剩余的铁,步骤③中加入适量稀硫酸与铁反应生成硫酸亚铁,最后将溶液2和3合在一起进行蒸发结晶即可得到硫酸亚铁晶体.故:
(1)步骤②中:需加入的物质是过量的铁置换硫酸铜溶液中的铜.
(2)步骤③中:需加入的物质是稀硫酸与铁反应生成硫酸亚铁,发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑;
(3)某同学认为经过步骤②后所得固体就是纯净的铜,不需要进行步骤③,此不合理;因为要使Cu2+完全置换出来,必须加入过量的铁;
(4)为了达到资源综合利用的目的,把溶液2和溶液3合并后,经加热浓缩、结晶;过滤等操作得到硫酸亚铁晶体.
故答案为:
(1)Fe;(2)稀硫酸;Fe+H2SO4=FeSO4+H2↑;
(3)不合理;因为要使Cu2+完全置换出来,必须加入过量的铁; (4)结晶;过滤
点评:从废水中回收金属一般步骤先加入一种廉价金属置换出另一种金属,然后过滤,将过量金属除去即可.

练习册系列答案
相关题目
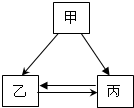 下列各组物质间通过一步反应就能实现如图转化,则甲、乙、丙可能的组合是( )
下列各组物质间通过一步反应就能实现如图转化,则甲、乙、丙可能的组合是( )| A、C CO2 CO |
| B、CuO CuCl2 Cu(OH)2 |
| C、NaOH NaCl NaNO3 |
| D、H2O H2O2 O2 |
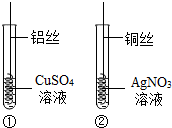 小亮为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验.请分析实验,完成填空.
小亮为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验.请分析实验,完成填空.