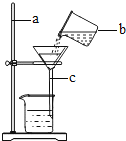
题目内容
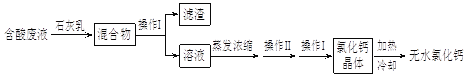
【题目】已知在化学反应中,反应前后有元素化合价变化的是氧化-还原反应。常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得氯酸钾。
![]()
(1)反应I中,通电时发生的反应方程式为![]() ,则X的化学式为______。该化学反应_______ ( 填“是”或“不是”)氧化还原反应。
,则X的化学式为______。该化学反应_______ ( 填“是”或“不是”)氧化还原反应。
(2)从反应Ⅱ来看,该转化中可以循环利用的物质是___________________________(填名称)。
【答案】H 2O 是 氯化钠
【解析】
(1)由质量守恒定律:反应前后,原子种类、数目均不变,则3X分子中含有6个氢原子和3个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O;在化学反应中,反应前后有元素化合价变化的是氧化还原反应,该化学反应前后氯元素和氢元素的化合价发生了改变,是氧化还原反应;
(2)既是反应物,也是生成物的物质,可以循环使用,氯酸钠溶液与氯化钾反应生成氯酸钾和氯化钠,该转化中可以循环利用的物质是氯化钠。

 阅读快车系列答案
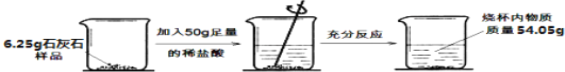
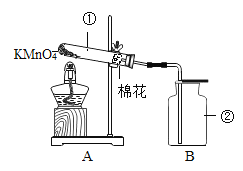
阅读快车系列答案【题目】某小组同学研究“影响H2O2生成O2快慢的因素”的课题。
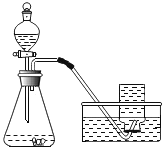
提出猜想:催化剂和反应物浓度都会影响H2O2生成O2的快慢。
实验过程:按图连接好装置,并检查装置气密性良好,
将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录(见表)
实验编号 | ① | ② | ③ |
反应物 | 6%H2O2100ml | 6%H2O2 | 4%H2O2100ml |
加入固体 | 0.6g氯化钠 | 0.6g二氧化锰 | |
收集气体的时间 | 155s | 41s | 75s |
(1)实验②中加入H2O2的体积为_____ml
(2)实验③中加入的固体和用量为_____。
实验结论:
(3)当外界条件一样时,反应物浓度越_____(填“浓”或“稀”),H2O2生成氧气速率越快:在H2O2生成氧气过程中,二氧化锰催化作用比氯化钠_____(填“强”或“弱”)。
反思:
(4)为了更好地证明二氧化锰和氯化钠是否对H2O2生成氧气快慢有影响,还应该增加一组对比实验,该实验选用的药品和用量为_____。
拓展:
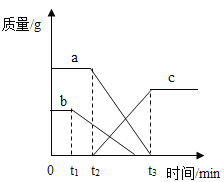
(5)进一步探究“MnO2的质量对H2O2分解反应的影响”,小组同学利用下图的装置进行实验,实验中用3%H2O2的溶液8ml与不同质量的MnO2混合,装置中产生氧气的量可以用压强传感器测出,(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计。)测得数据如图:
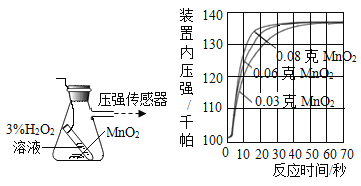
从图中可知,3%H2O2溶液8毫升与不同质量的MnO2混合时,其他条件相同的情况下,MnO2的质量越大,产生的氧气速率越_____。当MnO2的质最为0.08克时,产生氧气的速率刚好达到实验要求:在此实验条件下,现有2克MnO2,当它分解_____毫升3%H2O2溶液,其分解速率最接近实验要求。