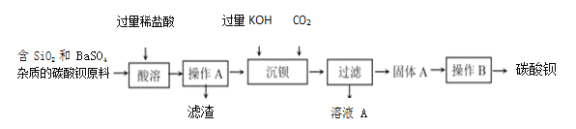
题目内容
【题目】某课外兴趣小组为探究“蜡烛燃烧产物中含有哪些成分”,于是进行如下实验。
(查阅文献)蜡烛的主要成分是石蜡,石蜡是由碳、氢元素组成。
(猜想与假设)蜡烛燃烧的产物是二氧化碳和水。
(设计实验)
(1)将内壁涂有澄清石灰水的小烧杯罩在蜡烛火焰上方,发现烧杯内壁出现浑浊现象,证明有二氧化碳生成,其反应的化学方程式为_____。
(2)另取一只冷而干燥的小烧杯罩在蜡烛火焰上方,观察到_____,证明有水生成。在实验中,小华观察到一个异常现象:小烧杯内壁上产生少量黑色物质。
(交流与讨论)同学们一致认为该黑色物质可能是石蜡不完全燃烧生成的_____,理由是_____,据此,他们猜想还可能产生一氧化碳。
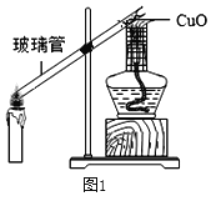
为验证存在该气体,小组成员设计图1所示的实验。
(设计实验)
(1)将玻璃管一段伸入蜡烛的焰心部分。
(2)用带有金属网罩的酒精灯加热另一端的氧化铜,一段时间后,观察到氧化铜由黑变红,证明蜡烛不充分燃烧有一氧化碳生成。对此,小明提出质疑:由以上现象不一定是生成了一氧化碳导致,还可能是_____。
同学们又在玻璃管中部放入_____重新实验,观察到黑色的氧化铜再次变红,由此确定蜡烛不充分燃烧有一氧化碳生成。
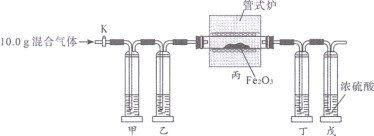
该兴趣小组欲利用数字化实验测定蜡烛发生不完全燃烧的产物,特设计如图2装置:收集含氧气50%的气体于钟罩内,将蜡烛点燃后放入钟罩,塞紧带有传感器的橡胶塞。实验过程中记录的相关数据如图3所示。请回答下列问题:
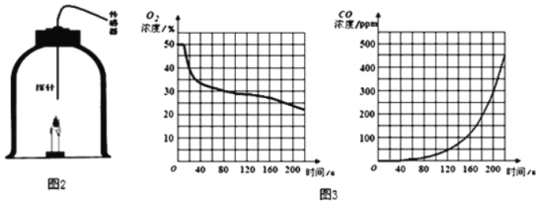
(1)在0~10s时,氧气浓度无明显变化的原因是_____。
(2)根据图象预测,蜡烛发生完全燃烧的时段为_____,结合图象说明理由_____。
(3)结合本实验记录的数据,写一条你的新认识_____。
【答案】CO2+Ca(OH)2=CaCO3↓+H2O 烧杯内壁出现水雾 炭黑 化学反应前后,元素种类不变,且石蜡中含有碳元素 蜡烛燃烧产生的炭黑还原了灼热的氧化铜 棉花 蜡烛燃烧后,瓶内氧气未充分混合均匀 0~40s 该时间段,氧气含量较高,并且没有生成一氧化碳 当氧气浓度约低于33%时,蜡烛已发生不完全燃烧
【解析】
[设计实验]
(1)证明有二氧化碳生成,是因为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,其反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。
故填:CO2+Ca(OH)2=CaCO3↓+H2O。
(2)另取一只冷而干燥的小烧杯罩在蜡烛火焰上方,观察到烧杯内壁出现水雾,证明有水生成。
故填:烧杯内壁出现水雾。
[交流与讨论]
同学们一致认为该黑色物质可能是石蜡不完全燃烧生成的炭黑,理由是化学反应前后,元素种类不变,且石蜡中含有碳元素。
故填:炭黑;化学反应前后,元素种类不变,且石蜡中含有碳元素。
[设计实验]
(2)由以上现象不一定是生成了一氧化碳导致,还可能是蜡烛燃烧产生的炭黑还原了灼热的氧化铜;
同学们又在玻璃管中部放入棉花重新实验,观察到黑色的氧化铜再次变红,由此确定蜡烛不充分燃烧有一氧化碳生成。
故填:蜡烛燃烧产生的炭黑还原了灼热的氧化铜;棉花。
(1)在0~10s时,氧气浓度无明显变化的原因是蜡烛燃烧后,瓶内氧气未充分混合均匀。
故填:蜡烛燃烧后,瓶内氧气未充分混合均匀。
(2)根据图象预测,蜡烛发生完全燃烧的时段为0~40s,理由:该时间段,氧气含量较高,并且没有生成一氧化碳。
故填:0~40s;该时间段,氧气含量较高,并且没有生成一氧化碳。
(3)结合本实验记录的数据可知,当氧气浓度约低于33%时,蜡烛已发生不完全燃烧,在空气中燃烧的蜡烛会发生不完全燃烧等。
故填:当氧气浓度约低于33%时,蜡烛已发生不完全燃烧。

【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1