题目内容
(10分)某学习小组的几位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)
(1)在铁皮表面镀锌是由于 (填字母)
A.锌没有铁活泼,镀在铁的表面可防止生锈
B.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈
(2)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。在实际操作中,甲同学的方案存在一个很大的问题是 。
(3)乙同学是通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应生成溶于水的盐,于是设计了如下方案:

a.写出步骤①中发生反应的化学方程式 ; 。
b.步骤③的操作是洗涤沉淀,为证明沉淀已洗净,写出操作和现象 。
(4)丙同学的方案是通过下图所示装置,测量镀锌铁皮与酸反应产生气体的质量来计算锌层的厚度。若使用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。丁同学认为,即使丙同学改用稀硫酸进行实验,测量结果仍不准确,你认为他的理由是 。

(5)丁同学设计通过测量镀锌铁皮与酸反应产生气体的体积来计算锌层的厚度,他设计了如下图所示装置:
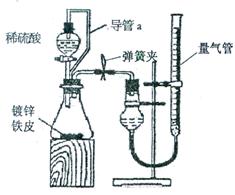
①检查量气装置气密性的方法是:连接好装置,关闭弹簧夹,从量气管注水,若观察到
,说明该量气装置气密性良好。
②反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 。
③若分液漏斗上方不连接导管a,则测出气体体积会 (选填“偏小”、“偏大”或“没有影响”)。
(1)在铁皮表面镀锌是由于 (填字母)
A.锌没有铁活泼,镀在铁的表面可防止生锈
B.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈
(2)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。在实际操作中,甲同学的方案存在一个很大的问题是 。
(3)乙同学是通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应生成溶于水的盐,于是设计了如下方案:

a.写出步骤①中发生反应的化学方程式 ; 。
b.步骤③的操作是洗涤沉淀,为证明沉淀已洗净,写出操作和现象 。
(4)丙同学的方案是通过下图所示装置,测量镀锌铁皮与酸反应产生气体的质量来计算锌层的厚度。若使用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。丁同学认为,即使丙同学改用稀硫酸进行实验,测量结果仍不准确,你认为他的理由是 。

(5)丁同学设计通过测量镀锌铁皮与酸反应产生气体的体积来计算锌层的厚度,他设计了如下图所示装置:

①检查量气装置气密性的方法是:连接好装置,关闭弹簧夹,从量气管注水,若观察到
,说明该量气装置气密性良好。
②反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 。
③若分液漏斗上方不连接导管a,则测出气体体积会 (选填“偏小”、“偏大”或“没有影响”)。
(1)B
(2)由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应。(3)Zn+2HCl=ZnCl2+H2↑;Fe +2HCl=FeCl2+H2↑;取最后一次洗涤液于试管中,滴几滴酚酞并振荡,若溶液不变色,则表示沉淀已洗净。(合理均给分)
(4)偏小 锌和铁的相对原子质量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高。另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠。
(5)①量气管中液面与左边液面形成高度差,一段时间后,两边高度差不变 ②上下移动量气管,直到与左边液面相平后再读数(写出一条即可) ③ 偏大
(2)由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应。(3)Zn+2HCl=ZnCl2+H2↑;Fe +2HCl=FeCl2+H2↑;取最后一次洗涤液于试管中,滴几滴酚酞并振荡,若溶液不变色,则表示沉淀已洗净。(合理均给分)
(4)偏小 锌和铁的相对原子质量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高。另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠。
(5)①量气管中液面与左边液面形成高度差,一段时间后,两边高度差不变 ②上下移动量气管,直到与左边液面相平后再读数(写出一条即可) ③ 偏大
(1)锌和铝一样,虽然活泼但在空气中容易形成致密的氧化膜,防止生锈,故选B;(2)铁与锌都是活泼金属,由于铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应;
(3)铁与锌分别与盐酸反应的化学方程式:Zn+2HCl=ZnCl2+H2↑;Fe +2HCl=FeCl2+H2↑;沉淀未洗净,可能含有氢氧化钠,故取最后一次洗涤液于试管中,滴几滴酚酞并振荡,若溶液不变色,则表示沉淀已洗净。
(4)因浓盐酸具有挥发性,所以会使结果偏小;锌和铁的相对原子质量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高。另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠;(5)注水法检查装置气密性,主要靠观察形成的液差的变化判断,故答案为:量气管中液面与左边液面形成高度差,一段时间后,两边高度差不变;②上下移动量气管,直到与左边液面相平后再读数;③导管a的作用是使锥形瓶和分液漏斗中的气体压强相同,便于液体滴下,且消除滴下液体对气体体积的影响,若分液漏斗上方不连接导管a,会使分液漏斗中压强高于锥形瓶中压强,使加快稀硫酸滴下的速度,使测量结果偏大。
(3)铁与锌分别与盐酸反应的化学方程式:Zn+2HCl=ZnCl2+H2↑;Fe +2HCl=FeCl2+H2↑;沉淀未洗净,可能含有氢氧化钠,故取最后一次洗涤液于试管中,滴几滴酚酞并振荡,若溶液不变色,则表示沉淀已洗净。
(4)因浓盐酸具有挥发性,所以会使结果偏小;锌和铁的相对原子质量差异不大,镀锌铁皮中两者的比例的改变造成与酸反应后产生氢气质量的改变非常微小,对称量的要求很高。另外在实验的过程中随着气体的产生也会带走水蒸气,造成实验结果的不可靠;(5)注水法检查装置气密性,主要靠观察形成的液差的变化判断,故答案为:量气管中液面与左边液面形成高度差,一段时间后,两边高度差不变;②上下移动量气管,直到与左边液面相平后再读数;③导管a的作用是使锥形瓶和分液漏斗中的气体压强相同,便于液体滴下,且消除滴下液体对气体体积的影响,若分液漏斗上方不连接导管a,会使分液漏斗中压强高于锥形瓶中压强,使加快稀硫酸滴下的速度,使测量结果偏大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目