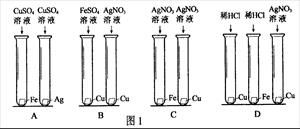
题目内容
由下图信息可知,金属活动性最不活泼的是


| A.镁 | B.锌 | C.铁 | D.铜 |
D
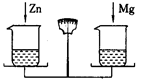
分析:在金属活动性顺序中,金属的位置越靠前,与酸反应生成氢气的速度越快.氢后面的金属不能与酸反应.
解答:解:由图示可知,镁、锌、铁的表面都有气泡产生,说明了在氢的前面;铜的表面没有气泡产生,说明了在氢的后面,所以,铜最不活泼.由此可知:
A、镁的表面产生的气泡最多,说明了与酸反应生成氢气的速度越快,镁最活泼.故A错误;
B、锌的表面产生的气泡较多,说明了与酸反应生成氢气的速度较快,锌较活泼.故B错误;
C、铁的表面产生的气泡较少,说明了与酸反应生成氢气的速度较慢,铁的活泼性较小,故C错误;
D、金属活动性最不活泼的是铜,故D正确.
故选D.
解答:解:由图示可知,镁、锌、铁的表面都有气泡产生,说明了在氢的前面;铜的表面没有气泡产生,说明了在氢的后面,所以,铜最不活泼.由此可知:
A、镁的表面产生的气泡最多,说明了与酸反应生成氢气的速度越快,镁最活泼.故A错误;
B、锌的表面产生的气泡较多,说明了与酸反应生成氢气的速度较快,锌较活泼.故B错误;
C、铁的表面产生的气泡较少,说明了与酸反应生成氢气的速度较慢,铁的活泼性较小,故C错误;
D、金属活动性最不活泼的是铜,故D正确.
故选D.

练习册系列答案
相关题目