题目内容
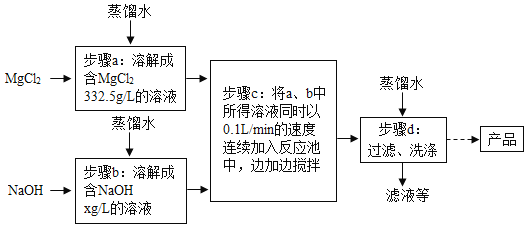
【题目】《梦溪笔谈》是宋代科学家沈括的一部科学巨著。书中写道:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,久之亦化为铜。”考古工作者曾发掘出一件宋代熬胆矾铁釜,考古人员在这件铁釜表面采集了两种固体A、B的样品进行研究,其中A的主要成分是Cu2(OH)2CO3,实验过程如下图所示,其中G、H、J、K是单质,气体C、E元素组成相同,部分生成物已略去。
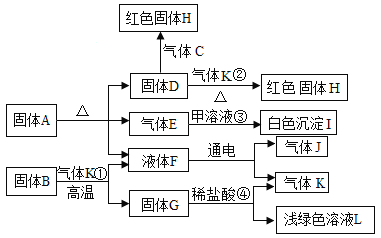
(1)写出下列物质的化学式: F ___ J ____。
(2)B中应含有__元素(写元素符号)。
(3)①②③④反应中不属于置换反应的是_____。
(4)写出②反应的的化学方程式___________。
(5)写出③反应的的化学方程式__________。
(6)固体H长期露置于潮湿的空气中会生成固体A,是因为H会和空气中的水、氧气、___反应。
【答案】H2O O2 Fe O ③ CuO + H2![]() Cu + H2O CO2+Ca(OH)2=CaCO3↓+H2O CO2
Cu + H2O CO2+Ca(OH)2=CaCO3↓+H2O CO2
【解析】
根据A的主要成分是Cu2(OH)2CO3,F通电得到两种气体,所以F是水,气体E通入甲溶液中得到白色沉淀I,所以E是二氧化碳,甲溶液为澄清石灰水,I为碳酸钙;固体D反应生成红色固体H,由此可知,D中含有铜元素,又能和气体C、K反应,说明D是氧化铜,H、J、K是单质,所以C可能为一氧化碳、K为氢气,因为水通电生成氧气和氢气,所以J为氧气;固体B和单质气体K反应产生水和G,因此B可能是氧化铁,G为铁;固体G和稀盐酸溶液反应产生氢气和浅绿色溶液L,所以G是铁,然后将推出的物质验证即可。
(1)由上述分析可知,F是H2O,J是O2,故答案为:H2O;O2;
(2)B可能是氧化铁,应含有Fe、O元素,故答案为:Fe、O
(3)反应①为氧化铁与氢气反应生成铁和水,为置换反应;
反应②为氧化铁与氢气反应生成铜和水,为置换反应;
反应③为二氧化碳与澄清石灰水反应,不是置换反应;
反应④铁与稀盐酸反应生成氢气和氯化亚铁,为置换反应,故①②③④反应中不属于置换反应的是③,故答案为:③;
(4)反应②是氧化铜与氢气反应,化学方程式为:CuO + H2![]() Cu + H2O,故答案为:CuO + H2
Cu + H2O,故答案为:CuO + H2![]() Cu + H2O;
Cu + H2O;
(5)反应③是气体二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(6)固体H长期露置于潮湿的空气中会生成固体A,是因为H会和空气中的水、氧气、CO2反应,故答案为:CO2。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某同学在做铝与酸反应的实验中发现了一个怪现象并记录于下表中,为了探究影响反应速率的因素及两者反应差异的原因,该同学做出了以下假设,你认为假设不合理的是
反应时间 | 1 | 2 | 5 | 15 | 20 | |
实验1 | 质量分数 | 极少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
实验2 | 质量分数 | 无明显现象 | 极少量气泡 | |||
A.与盐酸反应开始产生气泡速率慢的原因:铝片表面有氧化膜
B.与盐酸反应产生气泡速率越来越快的原因:反应放热,溶液温度升高
C.两者反应差异的原因:盐酸中有![]() ,稀硫酸中没有
,稀硫酸中没有![]()
D.两者反应差异的原因:![]() 对反应有促进作用,
对反应有促进作用,![]() 对反应有阻得作用
对反应有阻得作用
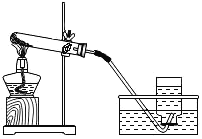
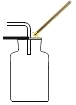
【题目】获悉某处矿井中瓦斯报警器发出警报后,学校兴趣小组请求该矿井安全监测人员提供了少量气体样品,进行成分探究。兴趣小组经资料查询,通常瓦斯气体可能含有CO、CO2、CH4等气体。为确定该气体是否含有这三种气体中的一种或几种,小组组长初步设计了如下实验方案供大家讨论:
(已知:![]() )
)
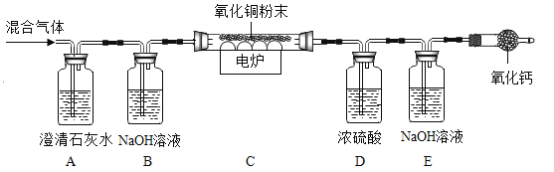
(1)实验装置末端干燥管中氧化钙的作用是______;
(2)同学乙认为,若装置C中CuO变红,则除了甲烷与CuO可能发生反应外,还可能发生的反应是___(用化学方程式表示);
(3)同学丙认为,欲通过D装置中浓硫酸因吸收水分而增重,说明混合气体中含有CH4的思路不严密,认为需要在____(填序号)间再增加一个D装置(编号为F),才能证明含有CH4;
(4)同学丁认为,B装置可有可无。说说你的看法和理由______;
(5)同学戊认为,该装置存在着___重大安全隐患,小组成员一致同意。
综合上述讨论,兴趣小组将经过安全处理后的混合气体,通过改进后的装置进行了实验探究,请根据实验现象和数据填写结论:
装置 | 实验现象/数据 | 实验结论 |
A | 石灰水变浑浊 | 通过实验现象和数据,小组成员一致认为该气体样品中含有______。 |
B | 无明显现象 | |
C | 黑色粉末变成红色 | |
D | 装置D增重3.6g | |
E | 装置E增重4.4g |
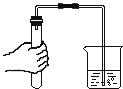
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用下图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mL CO2 | 镁条第3天开始变黑至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是 (用化学方程式表示)。
(2)实验1的目的是 。
(3)实验3中,试管内的气体主要含有CO2、 。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是 (填编号)。
(5)由上述实验可推知,镁条变黑的条件是 。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是 。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是 。