题目内容
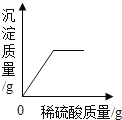
【题目】等质量的甲,乙两种金属分别与足量的溶质质量分数相同的稀硫酸反应产生氢气的质量与反应时间的函数关系如所示。下列相关判断中,错误的是
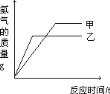
A. 金属活泼性乙比甲强 B. 若甲是铁,则乙可能是锌;若甲是铝,则乙可能是镁
C. 若稀盐酸的质量相等,则甲反应后所得溶液质量比乙大 D. 若将等质量的两种金属都放入足量的硫酸铜溶液中,则甲置换出铜的质量一定比乙多
【答案】C
【解析】
A、从图象中不难看出,金属乙的反应需要的时间短,说明金属乙的反应速率快,即金属乙的金属活动性强,金属乙比甲活泼,故正确;
B、铁与锌相比,铁的金属性比锌弱但相同质量的金属完全反应铁生成的氢气比锌多,符合图象;而若甲为铝,乙可以为镁,因为镁活泼,所以反应快,而生成氢气的质量也是铝的多,故正确;
C、反应前总量相等的情况下由于甲放出的氢气多,则溶液的质量少,故错误;
D、金属完全反应的情况下,甲比乙能置换出较多的氢气,可推得甲比乙能置换出较多的铜;故正确。
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)请根据下列实验装置图回答问题
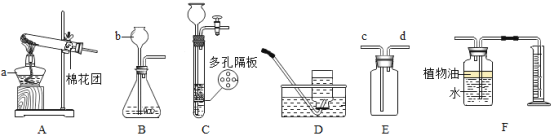
①写出下列仪器名称:b______
②若用氯酸钾与二氧化锰固体加热制取氧气,应选择的发生装置是______,若用E装置装满水将水排出收集氧气,则氧气应从______![]() 填“c”或“d”
填“c”或“d”![]() 口通入
口通入
③装置B、C都可用来制取二氧化碳,装置C相对于装置B在操作方面的优势是______。
④若用F收集![]() 并测量生成的
并测量生成的![]() 气体的体积,其中在水面上放一层植物油目的是______。
气体的体积,其中在水面上放一层植物油目的是______。
(2)某校探究小组,误把稀盐酸倒入盛有氢氧化钙溶液的烧杯中,于是他们对烧杯内溶液中溶质成分进行了探究。
I.写出该反应的化学方程式:______
![]() 探究烧杯内溶液的溶质的成分。
探究烧杯内溶液的溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜想)
猜想一:可能是![]() 和
和![]()
猜想二:可能只有![]() ;
;
猜想三:______
(查阅资料)氯化钙溶液呈中性。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量烧杯内溶液于试管中,滴入几滴酚酞试液,振荡。 | ______ | 猜想一不正确。 |
取少量烧杯内溶液于另一只 试管中,滴加碳酸钠溶液。 | ______ | 猜想二不正确,猜想三正确。 |
(反思与拓展)
烧杯中的溶液末经处理直按倒入下水道,可能造成的危害是______![]() 写一条
写一条![]() 。要处理烧杯内溶液,使其溶质只含有
。要处理烧杯内溶液,使其溶质只含有![]() ,应向烧杯中加入过量的______。
,应向烧杯中加入过量的______。