题目内容
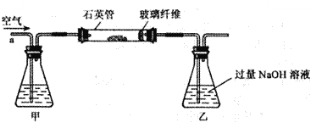
【题目】如下图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物.胃液中含有适量的甲,可帮助消化,图中“﹣”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物,生成物略去.

(1)写出甲的化学式 .
(2)①若乙在常温下为液体,丙可用来改良酸性土壤,则乙的化学式为 ,丙的化学式为 .
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙的化学式为 ,丙能与①中丙发生复分解反应,其化学方程式为 (写出一个即可).
③写出①中的乙和②中的乙发生化合反应的化学方程式 .
【答案】(1)HCl;(2)①H2O;Ca(OH)2;②CO2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH等;③CO2+H2O=H2CO3.
【解析】
试题分析:(1)胃液中含有适量的甲,可帮助消化,则甲为盐酸;(2)乙为水,丙为氢氧化钙;(3)根据题意知,乙为二氧化碳,丙能与①中丙发生复分解反应,则丙可为碳酸钠或氯化镁等;其化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或MgCl2+ Ca(OH)2= Mg(OH)2↓+ CaCl2

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目