��Ŀ����
����Ŀ����10�֣���������Ҫ�ɷ�ΪFeS2�����ʲ�����Ԫ�أ����ҹ���������᳧��ȡ�������Ҫԭ�ϡ���ѧ����С��Ϊ�ⶨij��������FeS2�������������µ�ʵ��̽��������ÿ����Ӧ����ȫ����
���������ϡ���4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��Na2SO3+H2O2��Na2SO4+H2O
��ʵ��̽����
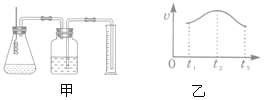
��. ��ȡ1.60 g��������Ʒ������ͼ��ʾװ�ã��гֺͼ���װ��ʡ�ԣ���ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����Ӧ��ȫ��
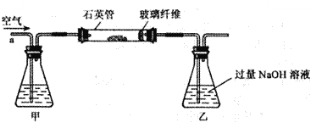
��. ��Ӧ��������ƿ�е���Һ�������´�����
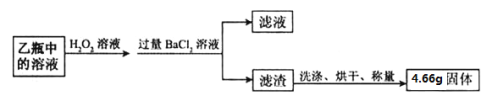
���������ۡ�
��1������װ���м�ƿ��ʢ�ŵ��Լ�������������Һ���������� ��
�������ⶨ��
��2���������յõ���4.66g������ �������ʵ����ƻ�ѧʽ����
��3������û�������FeS2����������������д��������̣�
��������˼��
��4�����ȱ�ټ�װ�ã������ղ��FeS2�������������� ���ƫ��ƫС�����䡱����
��5������֤������BaCl2��Һ�����ķ����� ��
����չӦ�á�
��ҵ���Ի�����Ϊԭ����������Ĺ�������ͼ������ʾ��
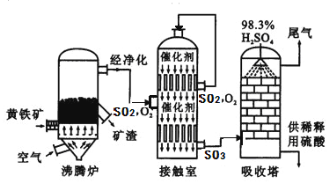
��6���Ӵ����з�����Ӧ�Ļ�ѧ����ʽΪ ����ѧʵ����������������Ϊ98%��Ũ���ᣬ����ʵ���г���Ҫ�õ���ϡ�����ᡣҪ��100g����Ũ����ϡ�ͳ���������Ϊ10%�����ᣬ��Ҫˮ�������� g��������һ����Ҫ�Ļ�����Ʒ����;ʮ�ֹ㷺����д��ϡ�����һ����; ��
��7��������������Ĺ�������ͼ������˵����ȷ���� ������ĸ����
A��Ϊʹ��������ȼ�գ��轫�����
B�������ܹ����SO2�ķ�Ӧ���ʺͲ���
C��SO2����Ϊ���������ԭ��ѭ��������
D������¯�ų��Ŀ����ɹ�����
���𰸡���1�����տ����еĶ�����̼��2��BaSO4 ��3��75% ��4��ƫ��
��5��ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ���������
��6��2SO2+O2![]() 2SO3 880 ȥ������ ��7��ACD
2SO3 880 ȥ������ ��7��ACD
��������
�������������װ���м�ƿ��ʢ�ŵ��Լ�������������Һ�������������տ����еĶ�����̼�������Ķ������������ں�������ķ�Ӧ�в����������ƣ������ƺͼ�����Ȼ�����Ӧ�����ˢ������յõ���4.66g������BaSO4����Ԫ�ص�������4.66g��32/233=0.64g FeS2��������0.64g/64/120=1.2g 1.2g/1.6g��100%=75%�����ȱ�ټ�װ�ã������ղ��FeS2��������������ƫ����Ϊ�����л���̼�ᱵ������֤������BaCl2��Һ�����ķ�����ȡ��Һ�������Թ��У��μ��Ȼ�����Һ����û�а�ɫ���������Ȼ����������Ӵ����з�����Ӧ�Ļ�ѧ����ʽΪ��������������ķ�Ӧ��������������Ĺ��̣�ϡ�����һ����;ȥ������ȣ�������������Ĺ�������ͼ��Ϊʹ��������ȼ�գ��轫����飻SO2����Ϊ���������ԭ��ѭ�������ã�����¯�ų��Ŀ����ɹ�������������ȷ�ġ�����Ҫ��ˮX����100=��100��+X����10% X=880��