题目内容
【题目】根据下列实验的创新与改进,回答问题。
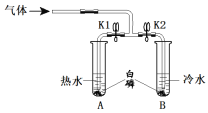
(1)取两支试管、导管、胶皮管和弹簧夹组成下图装置,并进行如下实验:
实验装置 | 实验步骤 |
| ①打开弹簧夹K1、K2,通入氮气,一段时间后,试管A、B中的白磷均无明显现象。 ②改通入氧气,试管A白磷燃烧,试管B无明显现象。 ③试管A白磷燃烧后冷却,测得溶液pH=1.65 |
①通入氧气后,试管A中反应的化学方程式是______________________________。
②能说明可燃物燃烧需要氧气的实验现象是________________________________。
③实验结束后,往试管A中的溶液里滴几滴紫色石蕊溶液,观察到溶液呈______色。
(2)实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应。实验操作和测定结果如图所示:
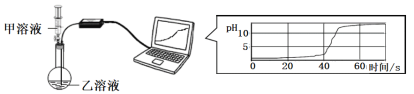
①该实验中,甲溶液是_________________溶液(填化学式)。
②能说明盐酸与氢氧化钠发生了化学反应的依据是____________________________。
【答案】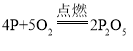 热水中的白磷通N2时不燃烧,通O2时却能燃烧 红 NaOH 溶液的pH不断变大,最后超过了7
热水中的白磷通N2时不燃烧,通O2时却能燃烧 红 NaOH 溶液的pH不断变大,最后超过了7
【解析】
(1)①通入氧气后,白磷燃烧,生成五氧化二磷,该反应的化学方程式为: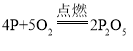 ;
;
②通入氮气,一段时间后,试管A中的白磷无明显现象,通入氧气后,试管A中的白磷燃烧,说明燃烧需要氧气,故填:热水中的白磷通N2时不燃烧,通O2时却能燃烧;
③试管A白磷燃烧后冷却,测得溶液pH=1.65,溶液显酸性,紫色石蕊试液遇酸变红,故填:红;
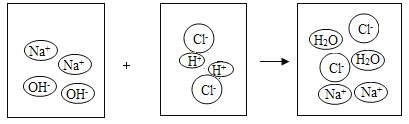
(2)①由图可知,一开始,pH<7,随着反应的进行,pH逐渐增大至大于7,故该反应是将氢氧化钠溶液滴入稀盐酸中,故甲溶液是:NaOH;
②氢氧化钠与盐酸反应生成氯化钠和水,盐酸显酸性,pH<7,氯化钠显中性,pH=7,氢氧化钠显碱性,pH>7,故溶液的pH不断变大,最后超过了7,说明氢氧化钠和盐酸发生了化学反应,故填:溶液的pH不断变大,最后超过了7。