题目内容
【题目】(1)化学实验室现有质量分数为98%的浓硫酸,但实验中常需要用较稀的硫酸。若要把20.0 g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是________ g。
(2)过氧化钙(CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑。某过氧化钙样品中含有少量不溶于水且不与水反应杂质,取该样品15.0 g投入盛有108.0 g水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气质量为3.2 g,计算该样品中过氧化钙的质量分数(写出计算过程)。___________________
【答案】176 96.0%
【解析】
(1)设需要加水的质量为x,20.0g×98%=(20.0g+x)×10%,x=176g;
(2)设该样品中过氧化钙的质量为y
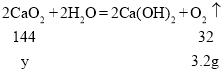
![]()
y=14.4 g
样品中过氧化钙的质量分数:![]()
答:样品中过氧化钙的质量分数为96.0%。

【题目】根据下列实验的创新与改进,回答问题。
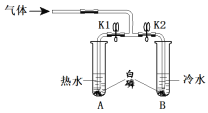
(1)取两支试管、导管、胶皮管和弹簧夹组成下图装置,并进行如下实验:
实验装置 | 实验步骤 |
| ①打开弹簧夹K1、K2,通入氮气,一段时间后,试管A、B中的白磷均无明显现象。 ②改通入氧气,试管A白磷燃烧,试管B无明显现象。 ③试管A白磷燃烧后冷却,测得溶液pH=1.65 |
①通入氧气后,试管A中反应的化学方程式是______________________________。
②能说明可燃物燃烧需要氧气的实验现象是________________________________。
③实验结束后,往试管A中的溶液里滴几滴紫色石蕊溶液,观察到溶液呈______色。
(2)实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应。实验操作和测定结果如图所示:
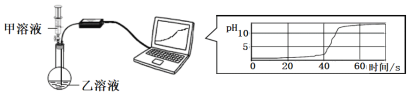
①该实验中,甲溶液是_________________溶液(填化学式)。
②能说明盐酸与氢氧化钠发生了化学反应的依据是____________________________。